
La polyarthrite rhumatoïde est une maladie articulaire inflammatoire et chronique qui touche plusieurs articulations, souvent celles des mains et des pieds (illustration).
HYRIMOZ 40 mg solution injectable est un nouveau médicament biosimilaire d'HUMIRA 40 mg solution injectable (adalimumab).
Cet inhibiteur du TNF-alpha a obtenu une AMM (autorisation de mise sur le marché) européenne dans les mêmes indications que son médicament biologique de référence HUMIRA (Cf. Tableau I).
HYRIMOZ est disponible en seringue préremplie ou en stylo prérempli SENSOREADY, contenant 0,8 mL de solution injectable (40 mg d'adalimumab). À noter que ces présentations dosées à 40 mg/0,8 ml sont différentes de celles actuellement disponibles pour la seringue préremplie ou le stylo prérempli d'HUMIRA 40 mg dont le volume d'injection est de 0,4 mL.
Tableau I - Indications thérapeutiques d'HYRIMOZ
| Polyarthrite rhumatoïde (Cf. VIDAL Reco "Polyarthriterhumatoïde") |
HYRIMOZ en association au méthotrexate est indiqué pour :
Il a été montré que l'adalimumab ralentit la progression des dommages structuraux articulaires mesurés par radiographie et améliore les capacités fonctionnelles lorsqu'il est administré en association au méthotrexate. |
| Arthrite juvénile idiopathique (Cf. VIDAL Reco "Arthrite juvénile idiopathique") |
Arthrite juvénile idiopathique polyarticulaire :
|
| Spondyloarthrite axiale (Cf. VIDAL Reco "Spondylarthrite ankylosante") | Spondylarthrite ankylosante (SA) :
|
| Rhumatisme psoriasique | HYRIMOZ est indiqué pour le traitement du rhumatisme psoriasique actif et évolutif chez l'adulte lorsque la réponse à un traitement de fond antérieur a été inadéquate. Il a été montré que l'adalimumab ralentit la progression des dommages structuraux articulaires périphériques tels que mesurés par radiographie chez les patients ayant des formes polyarticulaires symétriques de la maladie, et améliore les capacités fonctionnelles. |
| Psoriasis (Cf. VIDAL Reco "Psoriasis en plaques de l'adulte") | Psoriasis chez l'adulte :
|
| Hidrosadénite suppurée (HS) | HYRIMOZ est indiqué dans le traitement de l'hidrosadénite suppurée (maladie de Verneuil) active, modérée à sévère, chez les adultes et les adolescents à partir de 12 ans en cas de réponse insuffisante au traitement systémique conventionnel de l'HS. |
| Maladie de Crohn (Cf. VIDAL Reco "Maladie de Crohn") | Maladie de Crohn de l'adulte :
|
| Rectocolite hémorragique (Cf. VIDAL Reco "Rectocolite hémorragique") | HYRIMOZ est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère chez les patients adultes ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et la 6-mercaptopurine (6-MP) ou l'azathioprine (AZA), ou chez lesquels ce traitement est contre-indiqué ou mal toléré. |
| Uvéite | HYRIMOZ est indiqué dans le traitement de l'uvéite non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée. |
 HYRIMOZ fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
HYRIMOZ fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.HYRIMOZ bioéquivalent à HUMIRA
L'AMM européenne d'HYRIMOZ lui a été octroyée sur la base de :
- 4 études de phase I en dose unique, menées sur un total de 823 volontaires sains, ayant démontré l'équivalence pharmacocinétique d'HYRIMOZ par rapport au médicament de référence HUMIRA (Cf. Tableau II),
Tableau II - Résultats des études de bioéquivalence entre HYRIMOZ et HUMIRA
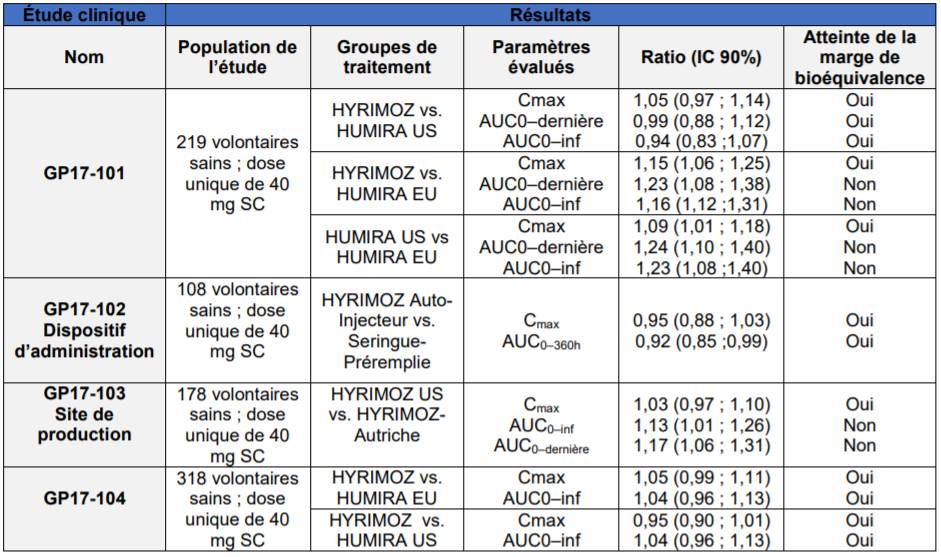
- une étude d'équivalence d'efficacité de phase III, randomisée, en double aveugle, réalisée chez 448 patient atteints de psoriasis en plaques, ayant démontré la similarité clinique d'HYRIMOZ par rapport à HUMIRA (version européenne) : l'amélioration du score PASI 75 (Cf. Encadré 1) à la semaine 16 par rapport à l'inclusion (critère de jugement principal) a été de 66,8 % dans le groupe HYRIMOZ et de 65 % dans le groupe HUMIRA, soit une différence de 1,8 % (IC 95 % [-7,46 ; 11,15]), comprise dans la marge d'équivalence prédéfinie [-18 ; 18], analyse PP.
Encadré 1 - Définition du score PASI
Le Psoriasis Area Severity Index est un score variant de 0 (aucune atteinte) à 72 (atteinte maximale), calculé à partir d'un algorithme qui intègre :
Les scores PASI 75 ou PASI 90 correspondent à une réduction du score PASI d'au moins 75 % ou d'au moins 90 % entre 2 évaluations. |
La tolérance d'HYRIMOZ, incluant l'immunogénicité, a par ailleurs été comparable à celle d'HUMIRA.
HYRIMOZ en pratique
Le traitement par HYRIMOZ doit être instauré et supervisé par un médecin spécialiste qualifié en matière de diagnostic et de traitement des pathologies dans lesquelles l'adalimumab est indiqué.
Il est recommandé aux ophtalmologistes de consulter un spécialiste approprié avant d'instaurer un traitement par HYRIMOZ.
Les patients traités par adalimumab doivent recevoir une carte de surveillance.
Pendant le traitement par HYRIMOZ, les autres traitements concomitants (tels que les corticoïdes et/ou immunomodulateurs) devront être optimisés.
HYRIMOZ est administré par voie sous-cutanée à l'aide de la seringue préremplie ou du stylo SENSOREADY.
Après une formation correcte à la technique d'injection et l'accord de leur médecin, les patients peuvent s'auto-injecter HYRIMOZ.
HYRIMOZ en pédiatrie : limites des présentations actuelles
Contrairement à HUMIRA qui dispose d'une présentation pédiatrique, HYRIMOZ est disponible uniquement en seringue préremplie et en stylo prérempli de 40 mg d'alalimumab. Par conséquent, il n'est pas possible d'administrer une dose inférieure à 40 mg d'alalimumab par injection avec HYRIMOZ.
Chez les patients pédiatriques qui nécessitent une dose inférieure à 40 mg, d'autres formulations d'adalimumab offrant une telle possibilité doivent être utilisées.
Conseils aux patients
Le stylo prérempli ou la seringue préremplie sont à usage unique et prêts à l'emploi.
Ils doivent être conservés au réfrigérateur, entre 2 °C et 8 °C, dans l'emballage extérieur à l'abri de la lumière.
HYRIMOZ (seringue ou stylo) peut être maintenu à des températures allant jusqu'à 25 °C pendant 14 jours maximum, à l'abri de la lumière. Passé ce délai, le médicament doit être jeté.
Il est recommandé d'attendre 15 à 30 minutes entre la sortie du réfrigérateur et l'injection pour ramener la solution injectable à la température ambiante.
Pour l'injection, le bas du ventre (sauf la région autour du nombril) ou le devant des cuisses sont des zones particulièrement appropriées.
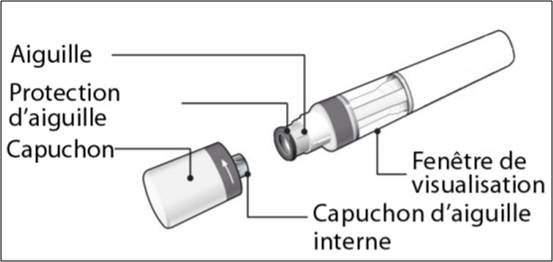
Manipulation du stylo SENSOREADY
Le stylo SENSOREADY est muni (Cf. Figure 1) :
- d'une fenêtre de visualisation pour le contrôle de la solution injectable,
- d'une aiguille protégée par un dispositif de sécurité,
- d'un capuchon, à ne retirer qu'au moment de l'injection. Le stylo doit être utilisé dans les 5 minutes suivant le retrait du capuchon.
Figure 1 - Les différentes parties du stylo HYRIMOZ SENSOREADY
Pour déclencher l'injection, il faut appuyer fermement le stylo contre la peau, en respectant un angle de 90 °.
Un premier clic indique le début de l'injection.
Au fur et à mesure de l'injection, la fenêtre de visualisation devient verte.
Un deuxième clic signale que l'injection est terminée et que le stylo peut être retiré.
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle, réservée aux spécialistes en rhumatologie, en pédiatrie, en médecine interne, en gastroentérologie et hépatologie, en dermatologie ou en ophtalmologie
- HYRIMOZ 40 mg/0,8 mL, boîte de 2 seringues préremplies, CIP 3400930155080, UCD 3400894403098
- HYRIMOZ 40 mg/0,8 mL, boîte de 2 stylos préremplis SENSOREADY, CIP 3400930155097, UCD 3400894402909
- Remboursable à 65 % selon la procédure des médicaments d'exception : prescription en conformité avec la fiche d'information thérapeutique (Journal officiel du 30 octobre 2018 - texte 18)
- Prix public TTC = 496,68 euros
- Agrément aux collectivités (Journal officiel du 30 octobre 2018 - texte 19)
- Inscrit sur la liste des spécialités prises en charge en sus des GHS (Journal officiel du 30 octobre 2018 - texte 20)
- Inscription dans le groupe adalimumab - Liste de référence des groupes biologiques similaires (ANSM, 6 juin 2019)
- Laboratoire SANDOZ
Périmètre de prise en charge d'HYRIMOZ
HYRIMOZ n'est pas remboursable dans :
|
Pour aller plus loin
Avis de la Commission de la Transparence - HYRIMOZ (HAS, 5 septembre 2018)
Inscription sur la liste de référence des groupes biologiques similaires (ANSM, 6 juin 2019)
Carte de surveillance des patients traités par HYRIMOZ (sur le site du laboratoire Sandoz)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 9 minutes
9 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)
.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.