Représentation en 3D d'un polynucléaire neutrophile (illustration).
ZIEXTENZO 6 mg solution injectable en seringue préremplie est une nouvelle spécialité à base de pegfilgrastim, un facteur de croissance de la lignée granulocytaire (G-CSF) qui régule la production et la libération des polynucléaires neutrophiles à partir de la moelle osseuse.
Nouveau biosimilaire de NEULASTA 6 mg solution injectable, ZIEXTENZO est indiqué dans la réduction de la durée des neutropénies (Cf. VIDAL Reco "Agranulocytose et neutropénie") et de l'incidence des neutropénies fébriles chez les patients adultes traités par une chimiothérapie cytotoxique pour une pathologie maligne (à l'exception des leucémies myéloïdes chroniques et des syndromes myélodysplasiques).
 ZIEXTENZO fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
ZIEXTENZO fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.ZIEXTENZO bioéquivalent à NEULASTA
Dans son avis du 5 décembre 2018, la Commission de la Transparence a évalué ZIEXTENZO sur la base de trois études d'équivalence :
- une étude de phase I en dose unique, conduite auprès de 184 volontaires sains, ayant démontré l'équivalence pharmacocinétique de ZIEXTENZO par rapport au médicament biologique de référence (NEULASTA) par voie sous-cutanée ;
- deux études d'équivalence d'efficacité de phase III, contrôlées, randomisées, en double aveugle, ayant comparé ZIEXTENZO et NEULASTA chez des patientes ayant un cancer du sein à un stade précoce et recevant une chimiothérapie adjuvante ou néoadjuvante par docétaxel, doxorubicine et cyclophosphamide. Le critère de jugement principal était la durée moyenne de neutropénie (moins de 0,5 x 109 polynucléaires neutrophiles/L) dans le cyle 1. Les résultats de l'analyse dans la population ITT (intention de traiter) ont été :
- PROTECT-1 (n = 316) : 0,75 jour dans le groupe ZIEXTENZO et 0,83 jour dans le groupe NEULASTA, soit une différence moyenne NEULASTA moins ZIEXTENZO de 0,07 jours (IC 95 % : -0,12 ; 0,26) ;
- PROTECT-2 (n = 308) : 1,36 jours dans le groupe ZIEXTENZO et 1,19 jours dans le groupe NEULASTA, soit une différence moyenne NEULASTA moins ZIEXTENZO de -0,16 jours (IC 95 % : -0,40 ; 0,08).
Ces résultats ont été confirmés par ceux de l'analyse dans la population PP (per protocole).
En termes de tolérance, le profil de ZIEXTENZO a été comparable à celui de NEULASTA.
Sur la base de ces résultats, la bioéquivalence de ZIEXTENZO avec NEULASTA a été démontrée.
En conclusion de son avis, la Commission de la Transparence a attribué un service médical rendu (SMR) important à LYNPARZA dans son indication d'AMM (autorisation de mise sur le marché), sans amélioration du SMR (ASMR V) par rapport au médicament biologique de référence, NEULASTA 6 mg solution injectable.
ZIEXTENZO en pratique
Le traitement par ZIEXTENZO doit être instauré et supervisé par un spécialiste en oncologie et/ou en hématologie.
L'injection est sous-cutanée, dans la cuisse, l'abdomen ou le haut du bras.
ZIEXTENZO devant être conservé au réfrigérateur entre 2 °C et 8 °C, il est conseillé de ramener la solution injectable à température ambiante pendant 15 à 30 minutes avant l'injection.
ZIEXTENZO peut toutefois supporter d'être exposé à température ambiante (sans dépasser 25 °C) pendant une période unique maximale de 72 heures. Passé ce délai, il doit être éliminé.
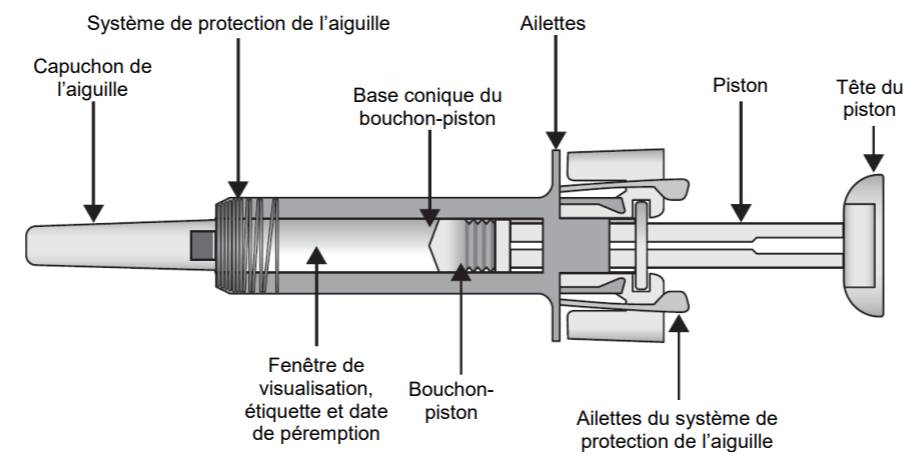
La seringue préremplie est équipée d'un système de protection de l'aiguille. Ce système recouvre l'aiguille après l'injection.
Une fenêtre de visualisation permet d'inspecter le produit avant injection pour mettre en évidence l'absence de particules (Cf. Figure 1).
À noter qu'une agitation excessive peut provoquer la formation d'agrégats de pegfilgrastim rendant la solution biologiquement inactive. Seule une solution limpide et incolore à jaune pâle peut être injectée.
Figure 1 - Représentation de la seringue préremplie de ZIEXTENZO
- Traçabilité renforcée
Identité administrative
- Liste I
- Prescription initiale hospitalière trimestrielle
- Boîte de 1 seringue préremplie de 0,6 mL avec aiguille, CIP 3400930162743
- Remboursable à 100 % (Journal officiel du 16 avril 2019 - texte 13)
- Prix public TTC = 596,92 euros
- Agrément aux collectivités (Journal officiel du 16 avril 2019 - texte 14)
- Inscription sur la liste de référence des groupes biologiques similaires - Groupe Pegfilgrastim (ANSM, décision du 15 mars 2019)
- Laboratoire Sandoz
Pour aller plus loin
Avis de la Commission de la Transparence - ZIEXTENZO (HAS, 5 décembre 2018)
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)
.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.