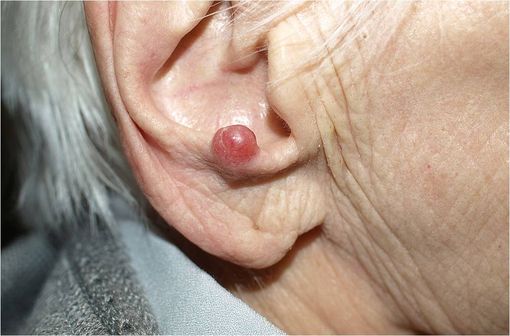
Carcinome à cellules de Merkel chez une patiente âgée de 94 ans (illustration @Klaus D. Peter, sur Wikimédia).
BAVENCIO 20 mg/mL solution à diluer pour perfusion IV (intraveineuse) est un nouvel antinéoplasique hospitalier indiqué en monothérapie dans le traitement de patients adultes atteints de carcinome à cellules de Merkel (CCM) métastatique.
Le principe actif de BAVENCIO est l'avélumab, un nouvel anticorps monoclonal IgG1 dirigé contre le ligand de la protéine de mort programmée 1 (PD-L1) [Cf. Encadré 1].
Encadré 1 - Mécanisme d'action de l'avélumab
(d'après l'Avis de la Commission de la Transparence du 19 septembre 2018)
(d'après l'Avis de la Commission de la Transparence du 19 septembre 2018)
| L'avélumab est un anticorps monoclonal humain de type immunoglobuline G1 (IgG1), dirigé contre le ligand de la protéine de mort programmée 1 (PD-L1). Il se lie au PD-L1 et bloque l'interaction entre le PD-L1 et ses récepteurs, PD-1 (protéine de mort programmée 1) et B7.1. Cela conduit à la suppression des effets inhibiteurs du PD-L1 sur les lymphocytes T CD8+ cytotoxiques, rétablissant ainsi les réponses anti-tumorales des lymphocytes T. Il a également été montré qu'avélumab induit une lyse directe des cellules tumorales par les cellules Natural Killer (NK) via la cytotoxicité à médiation cellulaire dépendante des anticorps (CCDA). |
BAVENCIO est un médicament orphelin qui a reçu une autorisation de mise sur le marché (AMM) européenne conditionnelle en 2017, ce qui signifie que des preuves supplémentaires sont attendues et que toute nouvelle information sur ce médicament sera réévaluée par l'Agence européenne du médicament (EMA) chaque année et, si nécessaire, le résumé des caractéristiques du produit (RCP) sera mis à jour.
En France, BAVENCIO a bénéficié d'une autorisation temporaire d'utilisation (ATU) nominative dès 2016, puis d'une ATU de cohorte de février à décembre 2017.
 BAVENCIO fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
BAVENCIO fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.SMR important et ASMR IV chez les patients prétraités par chimiothérapie
Dans son avis du 19 septembre 2018, la Commission de la Transparence a évalué BAVENCIO sur la base d'une étude de preuve de concept, de phase II non comparative (Lancet Oncol 2016 et J Immunother Cancer 2018) comportant deux parties :
- partie A : patients précédemment traités par chimiothérapie ;
- partie B : patients naïfs de traitement pour leur CCM métastatique. Seules les données préliminaires issues d'une analyse intermédiaire sont disponibles. Pour rappel, l'AMM est conditionnée à la mise à disposition des résultats de cette partie B en 2020.
La Commission note qu'il "n'existe pas d'alternative médicamenteuse à BAVENCIO, hormis les soins de support, après échec d'une chimiothérapie, en raison des comorbidités et des contre-indications aux chimiothérapies non utilisées en 1re ligne".
Concernant la partie A de cette étude, la cohorte se composait de 88 patients préalablement traités par au moins une ligne de chimiothérapie (57 avaient eu une ligne antérieure et 27 deux lignes antérieures), d'âge médian de 72,5 ans et en bon état général (ECOG 0 : 55,7 % ou 1 : 44,3 %) lors de l'analyse principale, avec un suivi médian de 10,4 mois.
Le pourcentage de réponse globale confirmée évaluée par le comité de revue indépendant (critère de jugement principal) a été de 31,8 % (28/88) dont 9 % de réponse complète et 22,7 % de réponse partielle.
Après un recul supplémentaire (suivi médian de 16,4 mois et de 21,9 mois), ce pourcentage a été de 33 % (29/88) [Cf. Tableau I].
Tableau I - Résultats de la partie A de l'étude EMR 100070-003 ou JAVELIN Merkel 200 sur le critère de jugement principal
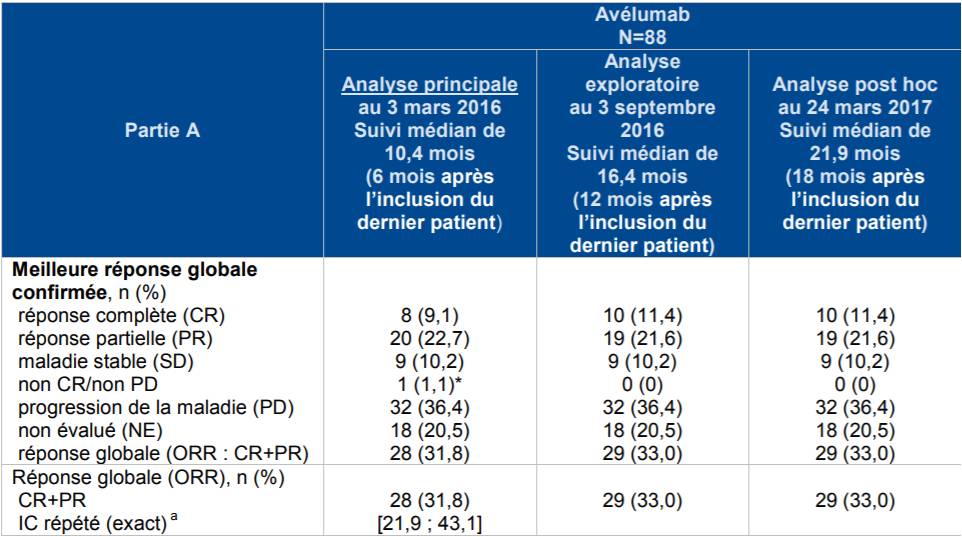
La Commission note que le laboratoire a comparé le pourcentage de réponse globale obtenu sous BAVENCIO à un seuil de 20 % qui correspondrait au pourcentage de réponse globale obtenu avec les chimiothérapies. Elle estime que "Le choix de ce seuil est discutable" car "il n'a pas été choisi sur la base d'une revue exhaustive de la littérature".
En termes de tolérance, les événements indésirables liés au traitement ont conduit à l'arrêt permanent du traitement chez 6,8 % des patients (n= 6). Ces événements étaient les suivants : élévation des transaminases, avec ou sans augmentation des GGT, suspicion de réaction auto-immune contre les plaquettes, augmentation des CPK (mais débutée avant l'étude), iléus en lien avec une pathologie sous-jacente et résolu.
Au moins un événement indésirable de grades > ou = 3 a été rapporté chez 68,2 % ; les plus fréquents ont été : anémie (10,2 %), lymphopénie (6,8 %), progression de la maladie (6,8 %) et hypertension (6,8 %).
Au total, 15,9 % des patients (n = 14) ont présenté au moins un événement d'origine immunologique parmi lesquels quatre étaient de grades > ou = 3.
Sur la base des données disponibles, la Commission de la Transparence estime que BAVENCIO apporte un service médical rendu (SMR) important et une amélioration du SMR mineure (ASMR IV) chez les patients préalablement traités par chimiothérapie "malgré les données disponibles ayant porté sur une étude simple bras, alors que la comparaison aux traitements usuellement utilisés était faisable, avec un faible effectif de patients prétraités par chimiothérapie, et malgré peu de données cliniques à long terme".
En pratique : perfusion intraveineuse, toutes les 2 semaines
Le traitement par BAVENCIO doit être instauré et supervisé par un médecin expérimenté en matière de traitement du cancer.
Une prémédication est nécessaire avant les 4 premières perfusions de BAVENCIO, avec un antihistaminique et du paracétamol. Si la quatrième perfusion a pu être réalisée sans que survienne de réaction liée à la perfusion, l'administration de la prémédication avant les doses suivantes sera laissée à l'appréciation du médecin.
- Modification de la dose ou suspension du traitement
En présence de certains effets indésirables et selon leur sévérité, une corticothérapie est mise en place.
- Préparation de BAVENCIO : dilution avant perfusion, conservation au frais
Une dilution préalable est nécessaire, dans une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ou une solution injectable de chlorure de sodium à 4,5 mg/mL (0,45 %).
Le flacon de BAVENCIO est à conserver au réfrigérateur entre 2 et 8 °C.
Après ouverture, le médicament doit être dilué et perfusé immédiatement (d'un point de vue microbiologique).
Identité administrative
- Liste I
- Médicament réservé à l'usage hospitalier
- Prescription réservée aux spécialistes en oncologie et aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Flacon de 10 mL, CIP 3400955041528
- Agrément aux collectivités - Cf. Encadré ci-après (Journal officiel du 1er mars 2019 - texte 22)
- Inscription sur la liste des spécialités prises en charge en sus des GHS (Journal officiel du 1er mars 2019 - texte 24)
- Laboratoire Merck Serono
Encadré - Périmètre de prise en charge de BAVENCIO
| En monothérapie dans le traitement de patients atteints de carcinome à cellules de Merkel (CCM) métastatique chez les patients adultes précédemment traités par chimiothérapie. EDIT du 21 août 2020 : Extension du périmètre de remboursement au traitement de 1re ligne, au stade avancé, du carcinome rénal uniquement à cellules claires ou comportant un contingent de cellules claires, en association à l'axitinib - Journal officiel du 28 juillet 2020 - texte 33. /FIN EDIT |
Pour aller plus loin
Avis de la Commission de la Transparence - BAVENCIO (HAS, 19 septembre 2018)
Etude pivot
Kaufman HL, Russell JS, Hamid O, et al. Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial. Lancet Oncol. 2016;17:1374-85
Kaufman HL, Russell JS, Hamid O, et al. Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after > ou = 1 year of follow-up : JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer. 2018, 6(1):7
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.