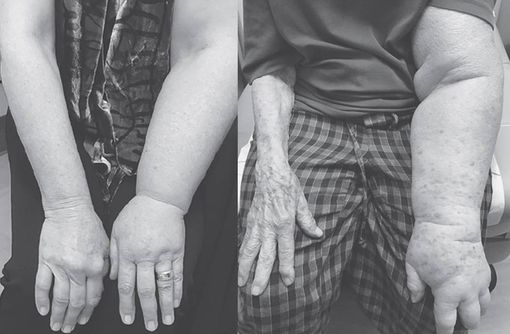
Lymphodème du bras modéré à gauche, avancé à droite (© NEJM 2018).
Lymphoedème du bras : des facteurs de risques liés aux traitements et au terrain
Stanley G Rockson, dans son article publié dans le New England Journal of Medicine en novembre 2018 2, rappelle les facteurs de risque de survenue d'un lymphoedème du bras chez les femmes atteintes d'un cancer du sein.
Voici les neuf facteurs de risque en lien avec le cancer du sein ou ses traitements :
- curage ganglionnaire (retrait d'un ensemble de ganglions lymphatiques de l'aisselle), avec ou sans chirurgie mammaire extensive ;
- radiothérapie du sein atteint ou des zones contenant des ganglions : aisselle, zone sous-claviculaire, zone située autour du sternum (localisation des ganglions lymphatiques mammaires internes) ;
- infection ou complications postopératoires (sutures, drains) ;
- trouble veineux du côté du sein atteint lié à la présence d'un cathéter veineux central, d'un pacemaker, d'un cathéter de dialyse ou d'une thrombose ;
- cancer avancé ou récurrent ;
- traumatisme du bras ;
- chimiothérapie à base de taxanes ;
- nombreux ganglions lymphatiques positifs (contenant des cellules cancéreuses), en particulier s'il y en a plus de 8 ;
- tumeur envahissant la capsule du sein.
En outre, deux facteurs sans lien avec le cancer du sein ou son traitement augmentent le risque de lymphoedème du bras :
- l'obésité ;
- l'hypertension artérielle (constat fait dans plusieurs études, mais pas dans toutes).
Un diagnostic posé sur les signes cliniques et le contexte
Les signes cliniques varient avec la durée et la gravité du lymphœdème.
- Aux premiers stades du lymphoedème, le patient peut signaler des changements subtils de la peau du bras ou de la main ou peut avoir de vagues sensations de lourdeur, d'inconfort, ou les deux.
- Initialement, le gonflement perçu, le plus souvent au niveau de l'avant-bras, est généralement léger et facilement déplacé par l'application d'une pression extérieure. La main est souvent épargnée. Il peut par contre y avoir un gonflement de l'aisselle, de la région de l'omoplate et du sein.
- Puis la peau et le derme s'indurent, deviennent fibreux, donnant au bras une texture "boisée".
- Aux stades plus avancés (après des semaines, des mois, voire des années), l'élévation du membre et la compression externe ne réduisent plus efficacement les gonflements du bras atteint. Ce dernier a augmenté de volume et a une "peau d'orange" épaissie et moins élastique, en raison de l'augmentation de l'épaisseur du tissu conjonctif sous-cutané et d'une hypertrophie adipeuse.
Dans de rares cas, un lymphœdème isolé de la poitrine ou de la paroi thoracique peut survenir sans lymphoedème du bras associé.
En sus de ces signes cliniques, les facteurs de risque évoqués ci-dessus doivent être recherchés, et les autres causes possibles d'œdème du bras doivent être éliminées :
- gonflement graisseux ("lipoedème", en général bilatéral) ;
- myxoedème (également en général bilatéral, dans un contexte d'hypothyroïdie connue ou non) ;
- thrombose veineuse profonde du membre supérieur (diagnostic différentiel pas toujours évident, reposant sur la douleur dans un cas sur deux, le constat d'une cyanose du bras, d'une atteinte de la main, d'une dilatation du réseau veineux supérieur, de D-dimères positifs, d'une échographie positive).
Examens complémentaires : à réaliser uniquement en cas de doute ou en cas de traitement chirurgical
Normalement, la clinique et les facteurs de risque (le plus souvent curage axiliaire et/ou radiothérapie) permettent de faire le diagnostic.
En cas de doute, l'examen recommandé est la scintigraphie des vaisseaux lymphatiques ("lymphoscintigraphie"). Cela permet, après injection dans la main de particules colloïdales radiomarquées, de visualiser la qualité du drainage lymphatique dans les ganglions axillaires. En cas de lymphoedème, cette visualisation est plus lente, avec une accumulation de la lymphe dans le derme ("refoulement dermique").
L'imagerie par résonance magnétique (IRM, ou "lympho-IRM") est cependant de plus en plus utilisée dans le diagnostic, ayant une meilleure spécificité (85,7 % vs 66,7 %) pour repérer un ralentissement de la circulation lymphatique et une meilleure sensibilité (100 % vs 83,3 %) pour le repérage des vaisseaux lymphatiques.
La lymphographie avec des nanoparticules fluorescentes émettant dans le proche infrarouge (vert d'indocyanine) est un nouveau moyen d'évaluation du lymphœdème. Elle est plus sensible que la lymphoscintigraphie dans les premiers stades du lymphœdème, mais ne permet pas une analyse quantitative. Elle est plutôt utilisée en cas de traitement chirurgical du lymphoedème, pour visualiser très précisément les voies lymphatiques.
L'échographie et le scanner ont une faible sensibilité et ne sont pas recommandés.
Traitement du lymphoedème du bras : drainage, bandages, exercices, compression pneumatique intermittente
Il n'existe pas de médicament permettant de traiter le lymphoedème du bras survenant chez les femmes atteintes d'un cancer du sein.
La prise en charge repose sur 15 à 30 interventions physiothérapeutiques avec un kinésithérapeute) sur 4 à 6 semaines :
- drainage lymphatique, technique de massage doux (étirement dirigé de la peau) qui stimule la contractilité lymphatique en douceur ;
- pose de bandages compressifs multicouches ;
- pratique d'exercices "décongestifs" (contraction douce et répétitive des muscles sous les bandages).
Une fois le lymphoedème dégonflé, la patiente peut continuer chez elle les exercices et massages manuels.
Cette approche associant drainage, bandages et exercices a démontré son efficacité, diminuant le volume de l'œdème et améliorant la qualité de vie (Moffatt CJ et al., Lymphatic Research and Biology 2018 3).
Elle peut être complétée en utilisant une compression pneumatique intermittente du bras (dispositif comportant un compresseur relié à un manchon pneumatique), qui a montré une réduction efficace de l'œdème (Karaca-Mandic Pet al. JAMA Dermatol 2015 4).
L'exercice physique, en particulier la musculation lente et progressive du bras, n'aggrave pas l'œdème et semble améliorer les symptômes des femmes atteintes.
La perte de poids en cas d'obésité ou de surpoids important paraît utile.
Quelle place pour la chirurgie ?
Dans certains cas, des techniques de microchirurgie (encore insuffisamment évaluées) sont utilisées pour tenter de restaurer la fonction lymphatique :
- la création microchirurgicale d'anastomoses lympho-veineuses permet, selon Cornelissen AJM et al. Lymphat Res Biol 2018 5, une réduction du volume et de la circonférence du bras, mais ces techniques doivent être considérées comme des alternatives au traitement standard décrit ci-dessus. Une telle approche en préventif, effectuée au moment du curage ganglionnaire, semble efficace (3 % de lymphoedèmes contre 15 % chez les femmes n'en n'ayant pas eu, selon l'étude de Ozmen T et al. parue en 2018 dans Ann Surg 6) ;
- des transplantations ganglionnaires autologues sont aussi, de plus en plus souvent, tentées, mais leurs résultats sont pour le moment mal évalués. Des études sont actuellement en cours pour déterminer si la prise de greffe peut être facilitée par l'utilisation d'échafaudages biologiques qui potentialiseraient la croissance et la migration des cellules endothéliales lymphatiques.
Pour les patients atteints de lymphœdème au stade avancé, une intervention chirurgicale à visée réductrice peut être pratiquée. Il s'agira d'une liposuccion du tissu adipeux sous-cutané hypertrophié sous anesthésie générale. Les études montrent une réduction du volume se maintenant plus de 15 ans après l'intervention (Brorson H. J Reconstr Microsurg 2016 7). Par contre, le port continu et assidu de vêtements compressifs est nécessaire après la liposuccion pour obtenir de bons résultats.
Prévention de la survenue d'un lymphoedème
L'expérience clinique suggère que les blessures, infections, inflammations de la peau peuvent jouer un rôle déclenchant dans la survenue d'un lymphoedème du bras. Il faut donc tenter de les éviter et, en tous cas, les traiter immédiatement en cas de facteurs de risque de lymphoedème (curage, radiothérapie, etc.).
Une controverse persiste, faute d'essais cliniques insuffisants, sur l'intérêt de ces quatre mesures d'évitement :
- évitement de la chaleur ;
- pas de prise de sang du côté du sein traité ;
- pas de brassard pour mesurer la tension sur le bras à risque (côté du sein traité) ;
- éviter si possible les voyages en avion.
Compte tenu de l'association entre le poids et le risque de lymphoedème, la perte de poids est généralement recommandée chez les patients qui sont en surpoids ou obèses, mais l'efficacité de cette mesure préventive n'a pas été formellement étudiée.
Chez les femmes à haut risque et acceptant une telle mesure, l'utilisation prophylactique d'un manchon de compression peut être conseillée.
Une surveillance préventive peut également être mise en place chez les femmes à risque, si elles l'acceptent, en pratiquant régulièrement (par exemple tous les 3 mois après la chirurgie ou la radiothérapie) une impédancemétrie (bio-impédance). Cela permet de détecter une augmentation de la quantité d'eau dans le bras et donc permettre une prise en charge précoce en cas de début de lymphoedème (notons que d'autres facteurs peuvent aussi entraîner une telle augmentation : prise de poids, sédentarité, fluctuations hormonales, etc.).
En savoir plus :
- Lymphedema - A Concise Compendium of Theory and Practice, Byung Boong Lee, John Bergan, Stanley G. Rockson, éditions Springer, 2011
- Lymphedema after Breast Cancer Treatment, Stanley G. Rockson, New England Journal of Medicine, novembre 2018 (objet de cet article)
- Moffatt CJ, Doherty DC, Franks PJ, Mortimer PS. Community-based treatment for chronic edema: an effective service model. Lymphat Res Biol 2018; 16: 92-9.
- Karaca-Mandic P, Hirsch AT, Rockson SG, Ridner SH. The cutaneous, net clinical, and health economic benefits of advanced pneumatic compression devices in patients with lymphedema. JAMA Dermatol 2015; 151: 1187-93.
- Cornelissen AJM, Beugels J, Ewalds L, et al. The effect of lymphaticovenous anastomosis in breast cancer-related lymphedema: a review of the literature. Lymphat Res Biol 2018 January 22 (Epub ahead of print).
- Ozmen T, Lazaro M, Zhou Y, Vinyard A, Avisar E. Evaluation of Simplified Lymphatic Microsurgical Preventing Healing Approach (S-LYMPHA) for the prevention of breast cancer-related clinical lymphedema after axillary lymph node dissection. Ann Surg 2018 May 23 (Epub ahead of print).
- Brorson H. Liposuction in lymphedema treatment. J Reconstr Microsurg 2016; 32: 56-65.
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.