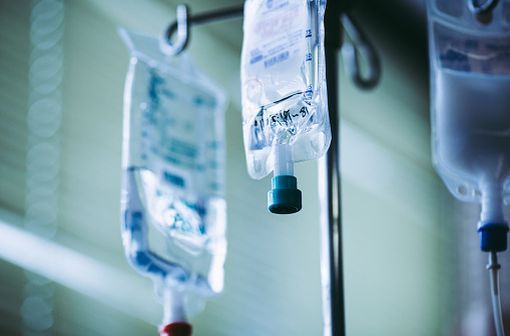
Administrées par voie IV stricte en perfusion, les solutions à base d'HEA doivent être utilisées à la phase initiale d'expansion volémique au maximum pendant 24 heures (illustration).
EDIT du 5 mars 2019 : Le programme d'accès contrôlé aux solutions à base d'hydroxyéthylamidon 130 entrera en vigueur le 16 avril 2019.
A compter de cette date, la commande des solutions HEA 130 sera conditionnée à une accréditation des hôpitaux et des professionnels de santé prescripteurs.
L'accréditation sera délivrée après réalisation de la formation pédagogique obligatoire.
Cette formation en ligne est obligatoire pour prescrire (pour tous les professionnels de santé prescripteurs d'un service hospitalier) et utiliser les solutions HEA 130 :
- https://academy.esahg.org/volumetherapy, durée 15 minutes
Des documents ont été élaborés pour accompagner les professionnels de santé, notamment une lettre d'engagement justifiant la réalisation de la formation (Cf. Infra Pour aller plus loin).
/FIN EDIT
Les solutions d'HEA restent utilisées dans des situations contre-indiquées
En 2013, des études cliniques ont mis en évidence une augmentation du risque d'atteinte rénale et de mortalité chez les patients présentant un sepsis ou chez les patients de réanimation ayant reçu des solutions pour perfusion à base d'hydroxyéthylamidon (notre article du 21 novembre 2018) [Cf. Encadré 1].
Encadré 1 - Spécialités de remplissage vasculaire à base d'hydroxyéthylamidon commercialisées en France
|
Ces données avaient alors conduit les autorités de santé à :
- restreindre l'indication des solutions d'hydroxyéthylamidon (HEA) au seul traitement de l'hypovolémie due à des pertes sanguines aiguës lorsque l'utilisation de cristalloïdes seuls est jugée insuffisante ;
- contre-indiquer ces solutions aux patients présentant un sepsis, une insuffisance rénale, et aux patients de réanimation (Cf. Encadré 2).
Encadré 2 - Liste des contre-indications applicables aux solutions pour perfusion d'HEA
|
Or, selon les résultats d'études d'utilisation initiées en 2017, les restrictions d'utilisation des solutions à base d'HEA ne sont pas suffisamment respectées.
Celles-ci restent toujours utilisées chez certains patients présentant des contre-indications :
- chez environ 9 % des patients de réanimation,
- environ 5 % à 8 % des patients présentant une insuffisance rénale,
- et environ 3 % à 4 % des patients présentant un sepsis.
Nouvelle mesure : restriction d'accès par un agrément spécifique
Dans ce contexte, l'EMA (Agence européenne du médicament) et l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) ont décidé de renforcer les mesures de restriction existantes applicables aux solutions pour perfusion à base d'HEA.
Ainsi, pour améliorer le bon usage des solutions d'HEA, une des mesures phares décidée par l'EMA est la mise en place d'un programme d'accès contrôlé.
Ce programme consiste à conditionner l'approvisionnement en solutions d'HEA à un agrément spécifique : seuls les hôpitaux/centres où les professionnels de santé devant les prescrire ou les administrer auront suivi une formation obligatoire sur les conditions d'utilisation appropriées auront la possibilité de recevoir ces médicaments.
Cette mesure sera mise en place par les titulaires d'AMM (autorisation de mise sur le marché) d'ici 9 mois.
En outre, il est également prévu de rendre l'affichage des mises en garde plus visible sur le conditionnement de ces solutions.
Les solutions pour perfusion à base d'HEA doivent être utilisées à la dose efficace la plus faible (< 30 ml/kg) et pendant la durée la plus courte possible (< 24 heures)
Le traitement doit être guidé par une surveillance hémodynamique continue de manière à arrêter la perfusion dès que les objectifs hémodynamiques appropriés ont été atteints.
Pour aller plus loin
Solutions pour perfusion à base d'hydroxyéthylamidon (HEA) : nouvelles mesures visant à renforcer les restrictions existantes - Point d'information (ANSM, 21 août 2018)
Lettre aux professionnels de santé : Solutions pour perfusion à base d'hydroxyéthylamidon (HEA) : nouvelles mesures visant à renforcer les restrictions existantes en raison d'un risque accru d'atteinte rénale et de mortalité chez les patients présentant un état critique ou un sepsis (sur le site de l'ANSM, août 2018)
EDIT du 5 mars 2019 : documents relatifs au programme d'accès contrôlé des solutions injectables HEA 130 :
- Lettre des laboratoires titulaires aux professionnels de santé (sur le site de l'ANSM, 4 mars 2019)
- Lettre d'engagement pour la prescription de solution pour perfusion à base d'hydroxyéthylamidon (HEA 130)
- Brochure pour les professionnels de santé (4 mars 2019)
- Fiche "Mesures additionnelles de réduction du risque"
Sur VIDAL.fr
Spécialités à base d'hydroxyéthylamidon : nouvelles recommandations d'utilisation (21 novembre 2013)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.