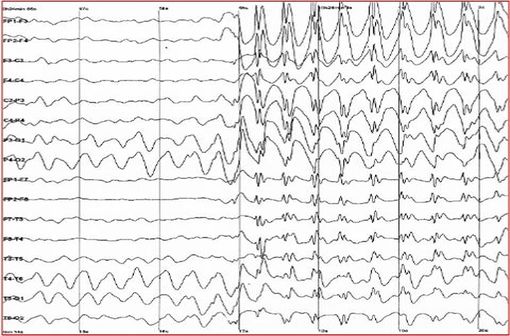
L'EEG des patients atteints de syndrome de Lennox-Gastaut est très altéré avec des anomalies intercritiques bifrontales et nombreuses, des pointes ondes généralisées (illustration @wikimedia).
Rupture de stock jusqu'à mi-septembre
Depuis le début du mois d'août, la forme buvable de l'antiépileptique TALOXA (felbamate), indiqué dans la prise en charge du syndrome de Lennox-Gastaut (Cf. Encadré 1), fait l'objet d'une rupture de stock.
Encadré 1 - Les indications de TALOXA
| Le felbamate n'est pas indiqué comme traitement antiépileptique de première intention. Le felbamate peut être prescrit dans l'indication suivante après une évaluation soigneuse du rapport risque/bénéfice prenant en compte le risque de toxicité hématologique, en particulier d'aplasie médullaire, et d'hépatotoxicité sévère. Le risque potentiel lié à l'utilisation du felbamate doit être mis en balance avec les risques associés à l'absence de traitement médical approprié. Syndrome de Lennox-Gastaut : en complément du traitement antérieur, traitement du syndrome de Lennox-Gastaut chez les patients à partir de 4 ans, non contrôlé par les autres médicaments antiépileptiques appropriés disponibles. Une évaluation rigoureuse de l'efficacité du felbamate doit être effectuée après 2 à 3 mois de traitement. Seuls les patients pour lesquels une amélioration clinique majeure de leur syndrome épileptique (ie réduction marquée de la fréquence des crises ou de leur sévérité) aura été constatée dans ce laps de temps devront continuer le traitement par le felbamate ( cf. Mises en garde et Précautions d'emploi). Les patients doivent être informés, avant l'instauration du traitement, du risque potentiel lié à l'utilisation du felbamate ( cf. Mises en garde et Précautions d'emploi). Les patients doivent être avertis que l'utilisation du felbamate a été associée à la survenue d'aplasie médullaire et d'insuffisance hépatique, toutes deux potentiellement mortelles ( cf. Mises en garde et Précautions d'emploi). |
La reprise de la distribution normale de TALOXA 600 mg/5 mL suspension buvable est annoncée pour mi-septembre 2017, selon l'information de sécurité publiée par l'ANSM le 22 août 2018.
Des mesures pour préserver les stocks résiduels
En attendant la remise à disposition normale de TALOXA 600 mg/5 mL suspension buvable, le laboratoire MSD émet des recommandation dans une lettre à destination des professionnels de santé en date du 18 août, visant à préserver les stocks encore disponibles :
- réserver la forme buvable aux seuls patients pour lesquels la forme en comprimé (TALOXA 600 mg comprimé) ne peut pas être utilisée. TALOXA 600 mg comprimé n'est pas en rupture de stock ;
- favoriser les dépannages entre les établissements hospitaliers. Le laboratoire MSD a recensé les unités de TALOXA 600 mg/5 mL encore disponibles dans les hôpitaux afin de faciliter les dépannages d'urgence ;
- retarder si possible la rétrocession de TALOXA suspension buvable aux patients, notamment dans le cadre d'un renouvellement anticipé du traitement pour le mois de septembre, tout en écartant le risque d'interruption du traitement ;
- en cas d'initiation de traitement, évaluer avec le prescripteur la possibilité de :
- reporter la date d'initiation,
- envisager une substitution par l'alternative thérapeutique INOVELON 40 mg/mL suspension buvable (rufinamide).
Pour mémoire
TALOXA est un médicament hospitalier, soumis à prescription restreinte (prescription initiale hospitalière de 6 mois par les neurologues ou les pédiatres), et rétrocédable aux patients ambulatoires.
Deux présentations sont disponibles, en comprimé à 600 mg et en solution buvable de 600 mg/5 mL en flacon de 230 mL.
Le médicament INOVELON, dont la forme buvable peut être envisagée en remplacement de TALOXA, est indiqué dans traitement adjuvant des crises d'épilepsie associées au syndrome de Lennox-Gastaut chez les patients âgés de 4 ans ou plus.
Pour aller plus loin
TALOXA 600 mg/5 ml, suspension buvable - Rupture de stock (ANSM, 25 août 2017)
Lettre du laboratoire aux professionnels de santé (sur le site de l'ANSM, 22 août 2017)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.