Représentation anatomique en 3D d'un pancréas humain (illustration).
Nouvelle insuline glargine à longue durée d'action
TOUJEO 300 unités/mL solution injectable SC en stylo prérempli est une insuline basale indiquée dans le traitement du diabète sucré de l'adulte (VIDAL Recos Diabète de type 1 et Diabète de type 2 : prise en charge initiale).
TOUJEO se présente en solution injectable à 300 unités/mL contenue dans une cartouche de 1,5 mL, scellée dans un stylo injecteur prérempli jetable SOLOSTAR.
Il s'agit d'une nouvelle formulation d'insuline glargine (insuline d'action lente) 3 fois plus concentrée que les spécialités déjà commercialisées à 100 unités/mL d'insuline glargine, LANTUS et son biosimilaire ABASAGLAR (notre article du 27 janvier 2016).
TOUJEO et LANTUS ne sont pas bioéquivalents
Le profil pharmacocinétique et pharmacodynamique de TOUJEO a été étudié au cours de 3 études de phase I, en comparaison avec LANTUS, insuline glargine dosée à 100 unités/mL.
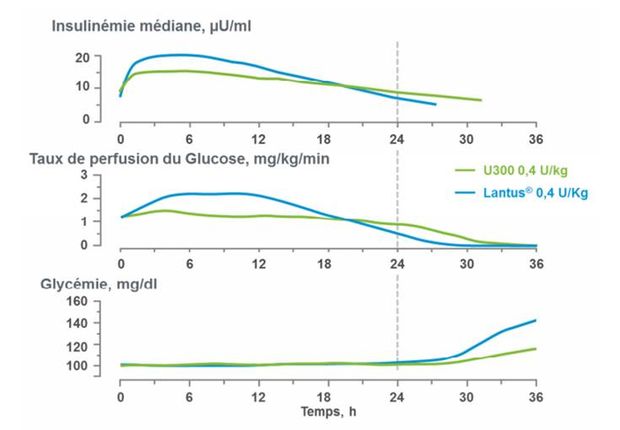
Selon les résultats de ces études, TOUJEO présente un profil plus plat et prolongé jusqu'à 36 heures (période d'observation), avec une moindre variabilité intra-individuelle que LANTUS.
En effet, l'exposition de l'insuline glargine est avec TOUJEO plus faible de 17 % sur 24 heures et comparable sur 36 heures (Figure 1). Ces différences cinétiques sont liées à un moindre taux d'absorption sous-cutanée de l'insuline glargine dosée à 300 unités/mL dont une proportion supérieure semble retenue et/ou dégradée dans le tissu cutané.
Figure 1 - Profil pharmacocinétique et pharmacodynamique de TOUJEO versus LANTUS d'après l'étude TDR 11626 (Extrait de l'Avis de la Commission de la transparence du 7 octobre 2015)
TOUJEO et LANTUS n'étant pas bioéquivalents, ils ne sont donc pas directement interchangeables :
- la transition de l'insuline glargine 100 unités/ml à TOUJEO peut nécessiter une dose plus élevée de TOUJEO (hausse de 10-18 % approximativement) pour atteindre des niveaux de glycémie plasmatique équivalents ;
- à l'inverse, la transition de TOUJEO à l'insuline glargine 100 unités/ml peut nécessiter une diminution de dose de l'insuline glargine 100 unités/mL (baisse de 20 % approximativement) pour réduire le risque d'hypoglycémie.
TOUJEO non inférieur à LANTUS en termes de réduction de l'HbA1c
L'efficacité de TOUJEO a été étudiée lors de quatre essais randomisés de phase III de non infériorité par rapport à LANTUS conduits sur 6 mois :
- chez des patients diabétiques de type 2 (DT2) :
- déjà traités par insuline basale avec un schéma basal bolus (EDITION 1),
- déjà traités par insuline basale en association avec des antidiabétiques oraux (EDITION 2),
- naïfs d'insuline traités par des antidiabétiques oraux (EDITION 3).
- chez des patients diabétiques de type 1 traités par un schéma basal bolus, randomisés en 2 groupes parallèles et recevant une injection le matin ou une injection le soir (EDITION 4).
Selon les résultats de ces études, TOUJEO a été non inférieur à LANTUS en termes de réduction de l'hémoglobine glyquée (HbA1c) après 6 mois de traitement (critère de jugement principal), avec une borne supérieure de l'IC95% < 0,4 % dans chacune des 3 études chez les DT2 et dans l'étude chez les DT1 (marge recommandée par l'EMA).
Moins d'hypoglycémies nocturnes chez les patients DT2 déjà traités par insuline
Entre la 9e semaine et le 6e mois de traitement, une réduction significative du risque de survenue d'hypoglycémies nocturnes confirmées et/ou sévères (critère secondaire d'efficacité) a été mise en évidence avec TOUJEO par rapport à LANTUS chez les patients DT2 déjà traités par insuline, avec :
- une réduction de 21 % dans EDITION 1 (p = 0,0045) ;
- une réduction de 23 % dans EDITION 2 (p = 0,0380).
Chez les patients DT1, TOUJEO et LANTUS ont été comparables sur les critères d'efficacité secondaires et notamment en termes :
- de survenue d'hypoglycémies nocturnes confirmées et/ou sévères entre la 9e semaine et le 6e mois de traitement ;
- de glycémie avant injection,
- de glycémie à jeun.
Un profil de tolérance comparable
En termes de tolérance, les résultats des études de phase II ou III conduites avec TOUJEO (n = 1 546 patients) et LANTUS (n = 1 550 patients) ont été comparables qu'il s'agisse :
- de la survenue d'événements indésirables, d'événements indésirables graves, de décès ou d'arrêts de traitement liés aux événements indésirables ;
- de l'incidence d'événements considérés comme liés au traitement à 6 mois, qui a été faible dans les 2 groupes (5,6 % vs 5,3 %), la plupart étant des hypoglycémies (0,5 % vs 0,7 %) et des céphalées (0,5 % vs 0,4 %) ;
- des taux d'événements indésirables d'intérêt particulier : réactions aux sites d'injection, réactions d'hypersensibilité, tumeurs malignes, événements cardiovasculaires et événements hépatiques.
Dans toutes les études, le taux d'hypoglycémies sévères nocturnes était légèrement inférieur avec TOUJEO.
Les hypoglycémies sévères ont été rapportées avec une fréquence du même ordre entre les deux groupes dans les 3 études de phases III conduites chez le DT2 (TOUJEO : 2,3 % vs LANTUS : 2,6 %) mais avec un taux inférieur avec TOUJEO par rapport à LANTUS chez les DT1 (6,6 % vs 9,5 %).
TOUJEO en 1re intention dans le DT1, en 2e intention dans le DT2
Dans son avis du 7 octobre 2015, la Commission de la transparence place TOUJEO dans la stratégie thérpeutique du diabète comme :
- un traitement de 1re intention dans la prise en charge du diabète de type 1,
- un traitement de 2e intention dans la prise en charge du diabète de type 2, où il représente une alternative à une insuline d'action intermédiaire (NPH) si le risque d'hypoglycémie nocturne sévère est préoccupant.
Compte tenu des données disponibles, la Commission a considéré que TOUJEO apporte un service médical rendu (SMR) important mais pas d'amélioration du SMR (ASMR V), en l'absence notamment de données de morbi-mortalité ou de qualité de vie des patients, les données présentées étant des essais de non infériorité portant sur un critère biologique intermédiaire, le taux d'HbA1c, comme critère principal.
TOUJEO en pratique
TOUJEO doit être injecté 1 fois par jour à n'importe quel moment de la journée, de préférence au même moment chaque jour.
Si nécessaire, un décalage de 3 heures maximum avant ou après l'heure d'administration habituelle peut être envisagé.
Chez les DT1, TOUJEO est toujours prescrit en association avec une insuline rapide pour couvrir les besoins en insuline prandiale.
Le résumé des caractéristiques du produit (RCP) n'indique pas de dose d'initiation mais précise que la dose doit être ajustée individuellement.
Chez le DT2, une dose d'initiation à 0,2 unité/kg est recommandée. Cette dose est ensuite ajustée individuellement.
- Quelles modalités de transition entre TOUJEO et une autre insuline ?
Le passage d'une autre insuline à TOUJEO nécessite des ajustements posologiques et doit être réalisé sous contrôle médical strict.
Une surveillance métabolique étroite doit être mise en place pendant la période de transition et les premières semaines qui suivent ce changement de traitement.
Plusieurs situations sont envisageables comme le passage d'une insuline glargine à 100 unités/mL à TOUJEO ou l'inverse, ou le passage d'une autre insuline basale (d'action intermédiaire ou d'action prolongée) à TOUJEO (Cf. monographie VIDAL - Rubrique Posologie et Mode d'administration)
- Injection sous-cutanée avec le stylo TOUJEO SOLOSTAR
D'une injection à l'autre, une rotation des sites d'injection dans une même zone d'injection est recommandée.
L'injection est réalisée avec le stylo TOUJEO SOLOSTAR, en appuyant sur le bouton injecteur pendant 5 secondes. Une aiguille neuve stérile doit être utilisée pour chaque injection.
Ce stylo présente les caractéristiques suivantes :
- il permet d'injecter de 1 à 80 unités en 1 fois ;
- la dose à injecter est affichée dans la fenêtre d'affichage. Seuls les chiffres pairs sont indiqués ;
- la sélection de la dose se fait par intervalle de 1 unité, à l'aide du sélecteur de dose. Il est possible de revenir en arrière ;
- il est possible d'estimer approximativement le nombre d'unités restantes dans le stylo en regardant où se situe le piston au niveau de l'échelle de dose d'insuline.
Dans le cas où la dose à injecter serait supérieure à 80 unités, cette dose doit être fractionnée en deux injections successives.
Si la quantité restante dans le stylo est insuffisante pour sélectionner la dose prescrite, un nouveau stylo doit être utilisé.
- Conseils au patient : vérifier l'étiquette de l'insuline utilisée
Afin de prévenir des erreurs médicamenteuses entre TOUJEO et une autre insuline, il est recommandé au patient de toujours vérifier l'étiquette de l'insuline avant chaque injection. Le dosage 300 est surligné en jaune sur l'étiquette du stylo TOUJEO SOLOSTAR.
Des documents à l'intention des professionnels de santé et des patients ont été élaborés dans le cadre du plan de gestion des risques :
- un guide destiné aux patients ;
- un guide destiné aux professionnels de santé ;
- une lettre d'accompagnement.
- Deux modes de conservation avant et après la première utilisation
Il est recommandé de sortir le stylo du réfrigérateur 1 heure au minimum avant la première utilisation.
Les stylos utilisés ne doivent pas être remis au réfrigérateur. Après la première utilisation, un stylo peut être conservé jusqu'à 4 semaines au maximum, à une température ne dépassant pas 30 °C et à l'abri de la chaleur directe ou de la lumière directe.
Identité administrative
- Liste II
- Boîte de 3 stylos, CIP 3400930016671
- Remboursable à 65 % (Journal officiel du 31 mai 2016 - texte 18)
- Prix public TTC = 45,21 euros
- Agrément aux collectivités (Journal officiel du 31 mai 2016 - texte 19)
- Laboratoire sanofi-aventis France
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 7 octobre 2015)
Résumé EPAR à l'intention du public (EMA, mise à jour du 25 janvier 2016)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.