Coupe histologique d'un carcinome à cellules squameuses, un type de carcinome non à petites cellules (illustration @AFIP - PEIR Digital Library, sur Wikimedia).
ZYKADIA 150 mg gélule (céritinib) est un nouvel agent antinéoplasique, inhibiteur des protéine-tyrosine kinases, indiqué dans le traitement du cancer bronchique non à petites cellules (CBNPC) avancé avec réarrangement du gène anaplastic lymphoma kinase (ALK)-positif chez les patients adultes préalablement traités par crizotinib (XALKORI).
Ces cas représentent une très faible portion des patients atteints d'un cancer du poumon non à petites cellules, de l'ordre de 4 à 5 %. Le céritinib appartient à la même classe thérapeutique que le crizotinib qui apporte une durée de réponse prolongée par rapport aux chimiothérapies et une bonne tolérance.
ZYKADIA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté. Un plan de gestion des risques (PGR) européen est prévu pour accompagner la commercialisation de ce médicament.
Une AMM conditionnelle dans l'attente de données comparatives d'efficacité
Ce médicament a été disponible sous le statut d'ATU (autorisation temporaire d'utilisation) de cohorte d'octobre 2014 à août 2015. Une AMM conditionnelle a été octroyée le 6 mai 2015, dans l'attente de preuves supplémentaires concernant ce médicament.
ZYKADIA a fait l'objet de deux études internationales, multicentriques, en ouvert et à bras unique (étude A et étude B). Les données comparatives d'efficacité issues des études cliniques randomisées ne sont pas encore disponibles.
L'étude A était une étude de phase 1 qui comprenait une phase d'escalade de dose et une phase d'expansion à la dose recommandée de 750 mg (n = 246 patients dont 163 préalablement traités par un inhibiteur ALK et 83 n'ayant jamais reçu d'inhibiteur ALK).
L'étude B était une étude de phase 2 dont l'objectif était d'évaluer l'efficacité et la tolérance du céritinib à la posologie de 750 mg chez 140 patients atteints d'un CBNPC ALK-positif localement avancé ou métastatique, qui avaient préalablement reçu 1 à 3 lignes de chimiothérapie suivie(s) d'un traitement par crizotinib, et qui avaient progressé sous crizotinib.
Le critère d'évaluation principal de l'efficacité pour ces études était le taux de réponse objective (TRO - "ORR : overall response rate"), défini comme la proportion de patients présentant comme meilleure réponse, une réponse complète (RC) ou partielle (RP) confirmée par des évaluations répétées effectuées au moins 4 semaines après que les critères de réponse aient été satisfaits pour la première fois.
Des évaluations supplémentaires portaient sur la durée de la réponse (DR) et la survie sans progression (SSP - "PFS progression free survival") évaluées par l'investigateur et par un comité de revue indépendante en aveugle (CRIA), ainsi que sur la survie globale (SG).
Les évaluations tumorales ont été réalisées selon les critères RECIST* V1.0 dans l'étude A et RECIST* V1.1 dans l'étude B.
* RECIST : Response Evaluation Criteria in Solid Tumors est la méthode de référence d'évaluation des traitements, basée sur la mesure de la taille des lésions (voir Fiche technique. Cancéro dig. Vol. 3 N° 1 - 2011 - 27-28).
Les principales données d'efficacité issues des études A et B sont résumées dans le tableau I.
Il en ressort que, chez les patients atteints de CBNPC avancé ALK-positif, préalablement traités par du crizotinib, ZIKADIA a permis d'obtenir :
- un taux de réponses objectives de 56,4 % et de 37,1% dans les études de phase 1 et de phase 2 respectivement.
- une durée moyenne de réponse* de 8,3 mois et de 9,2 mois, respectivement.
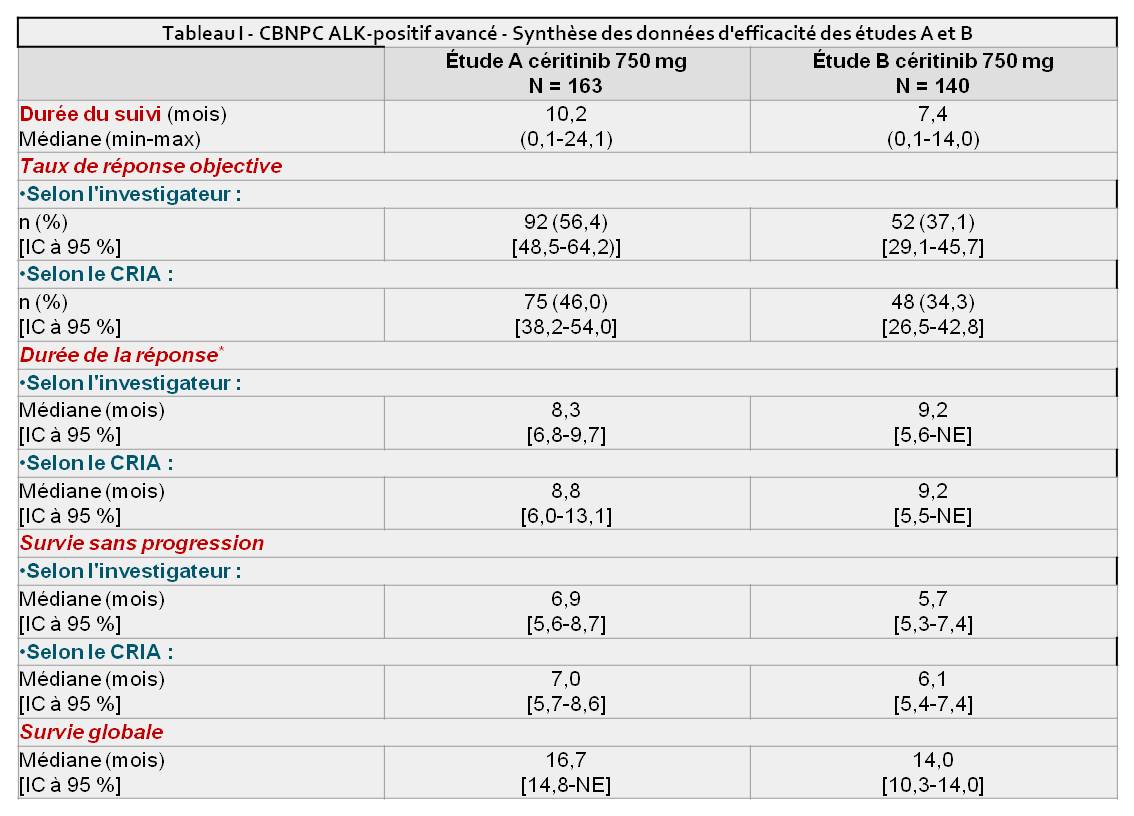 NE = non estimable.
NE = non estimable.* Inclut uniquement les patients ayant présenté une RC ou RP confirmée.
Dans ces deux études, les effets indésirables les plus fréquent ont été : diarrhée, nausée, vomissements, fatigue, tests hépatiques anomaux, douleurs abdominales, baisse de l'appétit, constipation, rash cutanés, hypercréatininémie, dysphagie et anémie.
Les effets indésirables les plus graves ont été : hépatotoxicité, toxicité gastro-intestinale, allongement de l'intervalle QT, bradycardie, pneumopathie interstitielle et hyperglycémie.
Céritinib, un nouveau principe actif inhibiteur des protéine-tyrosine kinases
Le céritinib est un nouveau principe actif, inhibiteur oral puissant et hautement sélectif de l'ALK (kinase du lymphome anaplasique), protéine qui intervient normalement dans la croissance de la cellule et le développement de nouveaux vaisseaux sanguins qui les alimentent.
Le céritinib est utilisé chez les patients souffrant de CPNPC ALK-positif, c'est-à-dire présentant une altération du gène responsable de la protéine ALK (voir Encadré 1).
| La protéine ALK joue un rôle majeur dans les voies de prolifération cellulaire, de différenciation et d'anti-apoptose. Elle fait partie de la famille des récepteurs de l'insuline. Son expression est normalement restreinte aux cellules du système nerveux central. En présence de son ligand, le récepteur transmet un signal de prolifération et de différenciation cellulaire, mais en son absence, il transmet un signal de mort cellulaire par apoptose. Le gène de fusion EML4-ALK (EML4 = Echinoderm Microtubule-Like protein 4 ; ALK = Anaplastic Lymphoma Kinase), décrit dans certains cancers du poumon, résulte d'une inversion au niveau du bras court du chromosome 2 aboutissant à l'expression d'une activité tyrosine kinase chimérique. Le gène muté est à l'origine de la production de la protéine chimérique EML4-ALK qui possède l'activité tyrosine kinase de la protéine ALK, et régule la transcription, sous la dépendance de la portion du gène EML4 insérée. La protéine chimérique EML4-ALK est caractérisée par une activation constitutive de la tyrosine kinase d'ALK, entraînant ainsi la prolifération cellulaire et la résistance à l'apoptose. Le réarrangement EML4-ALK rend la tumeur dépendante de cette mutation pour sa survie, désignée sous le terme d'addiction oncogénique. |
Le statut ALK-positif du CBNPC doit être confirmé avant l'instauration du traitement.
La recherche du statut ALK du CBNPC doit être réalisée par des laboratoires ayant des compétences reconnues dans l'utilisation d'une méthode d'analyse spécifique et validée pour sélectionner les patients ayant un CBNPC ALK-positif.
Une dose quotidienne de 750 mg, à jeun
La posologie recommandée de ZYKADIA est de 750 mg 1 fois par jour, par voie orale, à la même heure chaque jour.
Les gélules ne doivent pas être mâchées ou écrasées.
L'administration doit se faire à jeun et le patient ne doit pas consommer de nourriture au minimum pendant les deux heures qui précèdent et les deux heures qui suivent la prise du médicament.
L'administration de ZYKADIA avec des aliments augmente l'exposition systémique au céritinib.
Le traitement doit être arrêté chez les patients ne pouvant tolérer la dose de 300 mg par jour.
Surveillance et conduite à tenir en cas d'intolérance
Une surveillance étroite des patients traités par ZYKADIA s'impose afin d'identifier de manière précoce les effets indésirables qui nécessitent une prise en charge rapide par des mesures thérapeutiques standards.
Les effets indésirables nécessitant une éventuelle modification ou une interruption temporaire du traitement sont :
- une hépatotoxicité : un bilan hépatique (comprenant un dosage d'ALAT, d'ASAT et de la bilirubine totale) doit être réalisé avant l'instauration du traitement, toutes les 2 semaines le premier mois, puis une fois par mois ;
- une pneumopathie interstitielle diffuse ;
- un allongement de l'intervalle QT : une surveillance régulière par ECG et un suivi régulier des électrolytes (du potassium par exemple) sont recommandés chez les patients identifiés à risque (antécédents ou prédispositions à un allongement de l'intervalle QT) ;
- une bradycardie : la fréquence cardiaque et la pression artérielle doivent être surveillées régulièrement ;
- une toxicité gastro-intestinale : diarrhée, nausées et vomissements ;
- une hyperglycémie : la glycémie à jeun doit être mesurée avant l'instauration du traitement puis de manière périodique lorsque cela est cliniquement justifié ;
- une augmentation de la lipasémie et/ou de l'amylasémie : un dosage de la lipasémie et de l'amylasémie doit être réalisé avant le début du traitement puis périodiquement si cela est justifié cliniquement.
Conseils aux patients
Les gélules doivent être prises à jeun.
La consommation de pamplemousse ou du jus de pamplemousse doit être évitée. Par inhibition du CYP3A dans la paroi intestinale, cette consommation pourrait augmenter la biodisponibilité du céritinib.
Les femmes en âge de procréer doivent utiliser une méthode efficace de contraception pendant toute la durée du traitement et pendant au moins 3 mois après l'arrêt du traitement.
Identité administrative
- Liste I
- Prescription hospitalière, réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Boîte de 150, CIP 3400930015698
- Pris en charge selon les conditions définies à l'article L.162-16-5-2 du code de la Sécurité sociale
- Agréé aux Collectivités et rétrocédable par prolongation des conditions d'inscription au titre de l'ATU de cohorte
- Demande d'admission au remboursement et d'agrément aux collectivité à l'étude
- Laboratoire Novartis Pharma
Pour aller plus loin
Résumé EPAR pour le public (EMA, mise à jour du 9 juillet 2015)
Plan de gestion des risques européen (EMA, mise à jour du 9 juillet 2015)
Reco VIDAL Cancer du poumon

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.