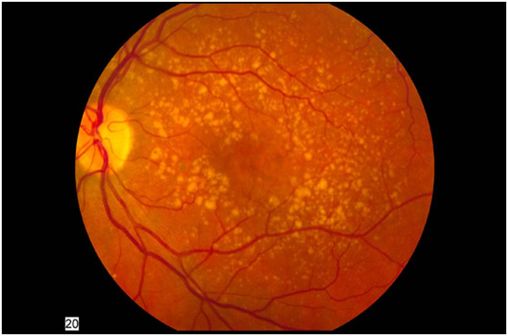
Fond d'oeil montrant une DMLA de stade intermédiaire (photo @ National Eye Institute of the NIH sur Wikimedia).
En octobre 2014, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) a demandé au laboratoire Roche de lui fournir toutes les données d'efficacité et de sécurité relatives à l'utilisation d'AVASTIN (bévacizumab) dans le traitement de la DMLA néovasculaire. Cette requête a constitué la première étape dans l'instruction de la RTU (recommandation temporaire d'utilisation) concernant l'utilisation d'AVASTIN en ophtalmologie (Cf. notre article du 6 novembre 2014).
Le 19 mars 2015, ces documents ont été présentés à la Commission d'évaluation initiale du rapport bénéfice/risque des produits de santé. Après examen de ces données, les membres de la Commission se sont prononcés en faveur de l'élaboration d'une RTU afin d'encadrer l'utilisation hors-AMM d'AVASTIN dans le traitement de la DMLA néovasculaire.
Avec cet avis, une nouvelle étape dans l'instruction de la RTU d'AVASTIN vient d'être franchie.
Une efficacité et une tolérance générale au moins équivalente
L'examen des données issues des essais et méta-analyses comparant AVASTIN et LUCENTIS dans le traitement de la DMLA a permis de conclure :
- à l'efficacité d'AVASTIN dans cette indication et à sa non-infériorité par rapport à LUCENTIS en termes d'efficacité fonctionnelle (acuité visuelle) ;
- qu'en termes de tolérance générale, AVASTIN ne présente pas de différence significative par rapport à LUCENTIS, hormis la survenue d'effets gastro-intestinaux ;
- que les effets indésirables oculaires observés sont ceux de tous les anti-angiogéniques administrés par voie intra-vitréenne tels que des infections intraoculaires (endophtalmies). Ces effets sont principalement liés au mode de préparation d'AVASTIN, qui requiert donc un encadrement strict à définir lors de la mise en place de la RTU.
Prochaine étape : soumission du projet de protocole de suivi au laboratoire Roche
Les membres de la Commission ont également examiné le projet de protocole de suivi de l'AVASTIN, qui prévoit notamment les conditions de prescription et de délivrance de cette spécialité et ses modalités de préparation.
Suite à l'avis favorable rendu par la Commission pour l'élaboration de la RTU d'AVASTIN en ophtalmologie, le Directeur général de l'ANSM, Dominique Martin, a décidé de poursuivre le processus d'instruction en soumettant le projet de protocole de suivi au laboratoire concerné.
A propos d'AVASTIN
AVASTIN 25 mg/ml solution à diluer pour perfusion contient le principe actif bevacizumab. AVASTIN est un médicament anti-cancéreux disponible uniquement à l'hôpital. Il est indiqué en association dans le traitement du cancer colorectal métastatique, du cancer su sein métastatique, du cancer bronchique non à petites cellules et du cancer du rein avancé et/ou métastatique.
Le bevacizumab neutralise l'activité biologique du VEGF (Vascular Endothelial Growth Factor), ce qui entraîne un blocage de la vasculogenèse et de l'angiogenèse. En oncologie, ce mode d'action anti-VEGF fait régresser les vaisseaux tumoraux, normalise les vaisseaux tumoraux restants, et inhibe la formation de nouveaux vaisseaux tumoraux, inhibant ainsi la croissance tumorale.
AVASTIN en ophtalmologie
L'utilisation hors-AMM d'AVASTIN en ophtalmologie repose sur le mode d'action anti-VEGF, qui est identique à celui d'autres médicaments ayant une AMM (autorisation de mise sur le marché) pour la prise en charge de la DMLA.
Actuellement, deux médicaments présentant ce mode d'action et ayant l'AMM dans la forme néovasculaire (humide) de la DMLA sont disponibles en France :
- LUCENTIS (ranibizumab) commercialisé par le laboratoire Novartis Pharma
- EYLEA (aflibercept) commercialisé par Bayer Healthcare.
Bien que la forme pharmaceutique d'AVASTIN soit destinée à être administrée en perfusion intraveineuse, l'expérience clinique hors-AMM en injection intravitréenne a fait l'objet de plusieurs publications au cours des dernières années (Cf. Ranibizumab versus Bevacizumab. Bibliographie fournie lors du séminaire du Conseil d'administration de l'ANSM du 13 février 2014).
Un argument : le coût de traitement
Sous réserve de la démonstration de son efficacité et de sa sécurité, le bevacizumab représente une alternative thérapeutique financièrement intéressante pour l'Assurance maladie étant donné son coût inférieur à celui des spécialités LUCENTIS et EYLEA. Cet argument a été mis en avant le 13 février 2014 lors d'un séminaire du Conseil d'administration de l'ANSM.
Pour mémoire, le prix UCD (unité commune de dispensation des médicaments délivrés uniquement en établissements de soins) d'AVASTIN 25 mg/ml solution à diluer pour perfusion est :
- pour le flacon de 4 ml (soit 100 mg de bévacizumab), de 272,61 euros TTC ;
- pour le flacon de 16 ml (soit 400 mg de bévacizumab), de 1 003,16 euros TTC.
Le prix public d'EYLEA solution injectable à 40 mg/ml en flacon de 100 µl (soit 4 mg d'aflibercept) est de 807,28 euros TTC.
Pour aller plus loin
Avastin 25 mg/ml (bevacizumab) : Avis favorable de la commission bénéfice/risque pour une recommandation temporaire d'utilisation (RTU) - Point d'Information (ANSM, 24 mars 2015)
Ranibizumab versus Bevacizumab. Bibliographie fournie lors du séminaire du Conseil d'administration de l'ANSM du 13 février 2014 (ANSM, 6 mars 2014)
Sur Vidal.fr
AVASTIN (bevacizumab) dans la DMLA : le laboratoire Roche sollicité par l'ANSM (6 novembre 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.