
L'électroencéphalogramme peut aider à localiser le foyer épileptogène.
Le libellé des indications de l'antiépileptique ZONEGRAN gélule (zonisamide) est désormais le suivant :
- en monothérapie dans le traitement de l'épilepsie partielle avec ou sans généralisation secondaire, chez le patient adulte présentant une épilepsie nouvellement diagnostiquée ;
- en association dans le traitement de l'épilepsie partielle avec ou sans généralisation secondaire chez les adultes, adolescents et enfants à partir de 6 ans.
Extension de l'indication chez l'adulte en monothérapie
Auparavant, ZONEGRAN était indiqué en association chez le patient adulte dans le traitement de l'épilepsie partielle avec ou sans généralisation secondaire.
Désormais, ZONEGRAN est également indiqué en monothérapie, chez le patient adulte présentant une épilepsie nouvellement diagnostiquée.
EDIT du 17 septembre 2015 : l'arrêté paru au Journal officiel du 8 septembre étend la prise en charge de ZONEGRAN 25 mg, 50 mg et 100 mg gélule à cette nouvelle indication /EDIT.
Selon l'avis de la Commission de la transparence du 23 juillet 2004, "De même niveau de preuve que les traitements ayant un niveau de preuve A dans le traitement de l'épilepsie partielle chez l'adulte (carbamazépine, lévétiracétam, phénytoïne), le zonisamide est une alternative thérapeutique à ces produits de par son profil de tolérance et d'interactions différents".
En effet, "dans la prise en charge de l'épilepsie partielle, nouvellement ou récemment diagnostiquée, une monothérapie est recommandée en première intention. En cas d'échec (réponse insuffisante, effets indésirables entraînant un arrêt de traitement) malgré une posologie et une observance adéquates du traitement, un autre antiépileptique en monothérapie doit être envisagé dans les mêmes conditions. Dans ce cas, les posologies du premier et du deuxième antiépileptique doivent être adaptées de façon à obtenir un relai progressif."
En pratique, la posologie de ZONEGRAN doit être adaptée en fonction de la réponse clinique.
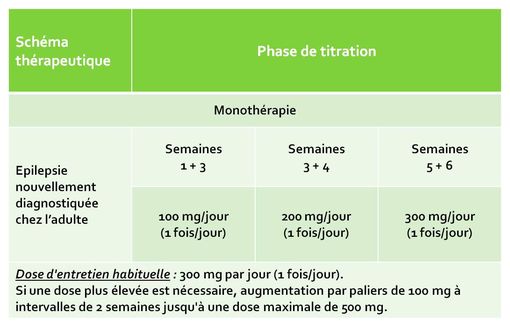
Le tableau 1 ci-dessous (extrait de la monographie VIDAL) présente le schéma de titration et les doses d'entretien, recommandés en monothérapie. Certains patients, particulièrement ceux qui ne prennent pas de médicaments inducteurs du CYP3A4, peuvent répondre à des doses inférieures.
Tableau 1 : Adultes - schéma d'augmentation de la posologie
et traitement d'entretien, recommandés en monothérapie
et traitement d'entretien, recommandés en monothérapie
Extension de l'indication en pédiatrie
Selon l'avis de la Commission de la transparence du 17 décembre 2014, "dans le choix du traitement antiépileptique, il est recommandé d'utiliser une bithérapie uniquement après l'échec d'au moins deux monothérapies à la dose maximale tolérée. Dans ce cas, ZONEGRAN constitue un moyen thérapeutique supplémentaire du traitement adjuvant des crises d'épilepsie partielle, avec ou sans généralisation secondaire, chez les adolescents et les enfants à partir de 6 ans".
EDIT du 17 septembre 2015 : l'arrêté paru au Journal officiel du 8 septembre étend la prise en charge de ZONEGRAN 25 mg, 50 mg et 100 mg gélule à cette nouvelle indication en pédiatrie /EDIT.
En pratique, ZONEGRAN doit être ajouté au traitement en cours chez les patients pédiatriques âgés de 6 ans et plus. La posologie doit être adaptée en fonction de la réponse clinique. Le tableau 2 présente le schéma de titration et les doses d'entretien, recommandés. Certains patients, en particulier ceux qui ne reçoivent pas de médicaments inducteurs du CYP3A4, peuvent répondre à des doses inférieures.
Tableau 2 : Population pédiatrique (à partir de 6 ans)
Schéma d'augmentation de la posologie et traitement d'entretien, recommandés
Schéma d'augmentation de la posologie et traitement d'entretien, recommandés
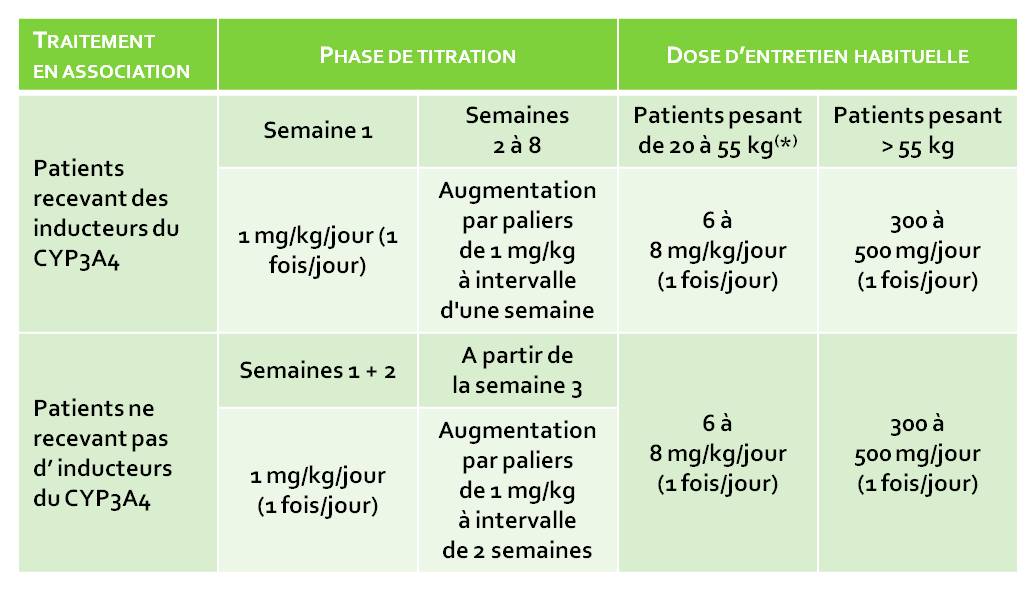
* Remarque : Pour garantir le maintien d'une dose thérapeutique, le poids de l'enfant doit être surveillé et la posologie ajustée en cas de modification du poids jusqu'à 55 kg. Le schéma posologique est de 6 à 8 mg/kg/jour jusqu'à une dose maximale de 500 mg/jour.
Mises en garde concernant les patients pédiatriques
Les mises en garde et les précautions d'emploi de ZONEGRAN s'appliquent aux adultes, aux enfants et aux adolescents.
En outre, le résumé des caractéristiques du produit (RCP) mentionne des mises en garde et des précautions d'emploi concernant plus particulièrement la population pédiatrique :
- risque d'hyperthermie et de déshydratation ;
- risque de perte de poids ;
- risque d'acidose métabolique, nécessitant une surveillance du taux de bicarbonate sérique ;
- risque de lithiase rénale ;
- risque d'anomalies de la fonction hépatique ;
- risque concernant les fonctions cognitives.
Conseils aux patients
Le risque d'hyperthermie et de déshydratation chez l'enfant est plus élevé par temps chaud.
Afin de limiter ce risque, l'enfant traité par ZONEGRAN doit respecter les recommandations suivantes :
- se rafraîchir le visage et le corps, en particulier lorsque le temps est chaud ;
- éviter les efforts physiques intenses, en particulier lorsque le temps est chaud ;
- boire beaucoup d'eau fraîche ;
- ne pas prendre les médicaments suivants :
- inhibiteurs de l'anhydrase carbonique tels que topiramate et acétazolamide,
- agents anticholinergiques tels que clomipramine, hydroxyzine, diphenhydramine, halopéridol, imipramine et oxybutynine.
- placer l'enfant dans un endroit frais, à l'ombre ;
- rafraîchir la peau de l'enfant avec de l'eau ;
- faire boire de l'eau fraîche à l'enfant.
Pour aller plus loin
Avis de la Commission de la Transparence du 23 juillet 2014 (HAS)
Avis de la Commission de la Transparence du 17 décembre 2014 (HAS)
Edit du 17 septembre 2015 :
Arrêté du 3 septembre 2015 modifiant la liste des spécialités pharmaceutiques aux assurés sociaux (Journal officiel du 8 septembre 2015)
Arrêté du 3 septembre modifiant la liste des spécialités agréées à l'usage des collectivités (Journal officiel du 8 septembre 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.