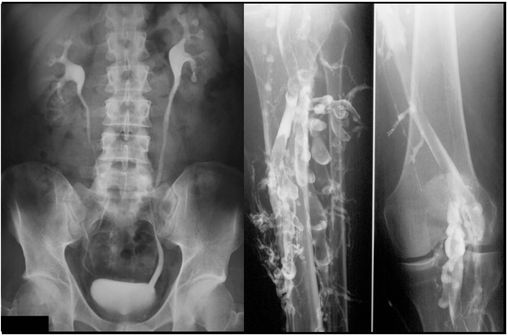
Urographie intraveineuse (à gauche) et phlébographie des membres inférieurs (à droite) [photos @ Glitzy queen00 et @ Hellerhoff, sur Wikimedia).
ULTRAVIST 300 et ULTRAVIST 370, en flacons de 100 ml et de 150 ml, sont désormais disponibles avec un nécessaire d'administration pour injecteur Medrad Stellant.
Ce nécessaire inclut :
- 1 seringue vide de 200 ml (polyéthylène téréphtalate) ;
- 1 raccord spiralé (PVC/polycarbonate/polypropylène) ;
- 1 microperfuseur de remplissage ;
- 1 cathéter de sécurité à ailettes IV 20G (canule polyuréthane/aiguille acier inoxydable chrome-nickel).
Elles s'ajoutent aux présentations d'ULTRAVIST déjà existantes.
A propos du nécessaire d'administration Medrad Stellant
Le flacon et le nécessaire d'administration sont destinés à un seul patient et pour usage unique.
Le produit de contraste restant après un examen, ainsi que le nécessaire d'administration ayant servi, doivent être jetés.
Le nécessaire d'administration est fourni uniquement en vue de l'administration d'ULTRAVIST et doit être employé conformément aux recommandations et à la signalétique du fabricant.
Il ne doit pas être utilisé chez les patients présentant une hypersensibilité connue à l'un des matériaux entrant dans sa composition (polyéthylène téréphtalate, PVC/polycarbonate/polypropylène, polyuréthane/aiguille acier inoxydable chrome-nickel).
L'administration de produit de contraste doit être réalisée par du personnel qualifié disposant d'un équipement et de procédures adaptés.
Toutes les injections de produit de contraste doivent être réalisées en utilisant une technique stérile.
Le produit de contraste doit être administré au moyen d'un injecteur en respectant les instructions du fabricant.
Pour mémoire
ULTRAVIST 300 et ULTRAVIST 370 sont des médicaments à usage diagnostique uniquement.
Ce sont des produits de contraste contenant respectivement 300 mg d'iode par ml et 370 mg d'iode par ml.
ULTRAVIST 300 est utilisé dans les situations suivantes :
- angiographie par voie artérielle ;
- artériographie des membres inférieurs ;
- artériographie cérébrale ;
- cavernographie ;
- arthrographie ;
- tomodensitométrie ;
- artériographie numérisée de la crosse aortique ;
- angiocardiographie infantile ;
- hystérosalpingographie ;
- opacification de l'appareil digestif ;
- phlébographie des membres inférieurs.
ULTRAVIST 370 est utilisé dans les situations suivantes :
- urographie intraveineuse ;
- tomodensitométrie ;
- angiographie par voie artérielle et veineuse ;
- aortographie par voie artérielle ;
- coronaroventriculographie.
Identité administrative
- Liste I
- ULTRAVIST 300, flacon de 100 ml + nécessaire, CIP 3400927797149, prix public TTC = 38,26 euros
- ULTRAVIST 300, flacon de 150 ml + nécessaire, CIP 3400927797200, prix public TTC = 55,23 euros
- ULTRAVIST 370, flacon de 100 ml + nécessaire, CIP 3400927799211, prix public TTC = 46,18 euros
- ULTRAVIST 370, flacon de 150 ml + nécessaire, CIP 3400927799389, prix public TTC = 67,12 euros
- Remboursable à 65 %
- Agrément aux collectivités
- Laboratoire Bayer Healthcare
Pour aller plus loin
Avis de la Commission de la transparence (HAS, 9 juillet 2014)
Les monographies en lien ci-dessous sont en cours de mise à jour concernant les informations contenues dans cet article à la date de sa publication.
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 2 minutes
2 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.