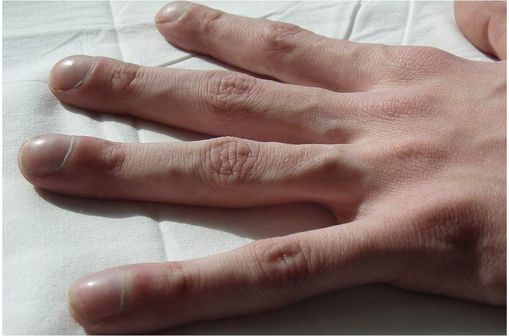
Hippocratisme digital témoignant d'une bronchopathie chronique obstructive (cliché @ Dr Jerry Nick sur Wikimedia).
KALYDECO 150 mg comprimé pelliculé (ivacaftor) sort de la réserve hospitalière.
A compter du 26 novembre 2014, il est disponible en ville.
KALYDECO est indiqué dans le traitement de la mucoviscidose chez les patients âgés de 6 ans et plus, porteurs de l'une des mutations de défaut de régulation (classe III) du gène CFTR (Cystic Fibrosis Transmembrane conductance Regulator) suivantes : G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N ou S549R.
KALYDECO est un médicament orphelin.
Il fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
A propos de l'ivacaftor
L'ivacaftor est un activateur sélectif de la protéine CFTR.
Il augmente l'activité des canaux défectueux chez les patients portant les mutations de défaut de régulation du gène CFTR (G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N ou S549R). L'ivacaftor permet ainsi de normaliser le transport d'ions à travers les canaux, de rendre les sécrétions moins épaisses et de soulager ainsi les symptômes de la maladie.
Le mécanisme exact par lequel l'ivacaftor potentialise l'activité de régulation du canal CFTR normal ou de certaines formes mutées de ce système n'est pas totalement élucidé.
Traitement de fond à prescrire d'emblée
Dans son avis rendu le 7 novembre 2012, la Commission de la transparence a précisé la place de KALYDECO dans la stratégie thérapeutique relative à la mucoviscidose : "KALYDECO représente un traitement de fond qui doit être prescrit d'emblée aux patients avec mucoviscidose âgés de plus de 6 ans porteurs de la mutation G551D du gène CFTR. La durée de traitement optimale n'est pas connue."
En pratique
La prescription de KALYDECO est réservée aux médecins expérimentés dans le traitement de la mucoviscidose.
Si le génotype du patient n'est pas connu, un génotypage par une méthode fiable et validée devra être réalisé, afin de confirmer la présence de l'une des mutations de défaut de régulation (classe III) précisées dans l'indication sur au moins un allèle du gène CFTR, avant d'instaurer le traitement.
Chez l'adulte, l'adolescent et l'enfant de 6 ans et plus, la posologie recommandée est de 150 mg (1 comprimé de KALYDECO) par voie orale toutes les 12 heures, soit une dose journalière totale de 300 mg.
Conseils aux patients
Le comprimé doit être avalé en entier (ne pas le croquer, le casser ou le dissoudre).
KALYDECO doit être administré avec un repas riche en graisses.
Les repas et collations mentionnés dans les recommandations pour la prise en charge des patients atteints de mucoviscidose ou les repas recommandés dans les conseils généraux de nutrition contiennent des quantités appropriées de graisses.
Les repas contenant des graisses sont, par exemple, ceux qui sont préparés avec du beurre ou des huiles ou ceux contenant des oeufs, du fromage, des fruits à coque, du lait entier ou de la viande.
La consommation de pamplemousse ou d'oranges amères doit être évitée durant le traitement. L'administration concomitante de KALYDECO et de jus de pamplemousse, qui contient un ou plusieurs composants inhibant modérément le CYP3A peut augmenter l'exposition à l'ivacaftor.
L'administration concomitante des médicaments (sans ordonnance) ou compléments alimentaires contenant du millepertuis (Hypericum perforatum) n'est pas recommandée (inducteur puissant du CYP3A).
Identité administrative
- Liste I
- Médicament soumis à prescription initiale hospitalière semestrielle
- Renouvellement non restreint
- Boîte de 56 comprimés, CIP 3400926606053
- Prix public TTC = 19 521,80 euros
- Remboursable à 65 % (non remboursable chez les patients porteurs des mutations G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N, S549R, demande en cours) selon la procédure des médicaments d'exception (en conformité avec la Fiche d'information thérapeutique)
- Agrément aux collectivités (sauf chez les patients porteurs des mutations G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N, S549R, demande en cours)
- Laboratoire Vertex
Pour aller plus loin
Fiche d'information thérapeutique (publiée au Journal officiel du 26 décembre 2013)
Avis de la Commission de la transparence (HAS, 7 novembre 2012)
Résumé à l'intention du public (EMA, mise à jour du 22 septembre 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
- HAS (Haute Autorité de santé)
- EMA (European Medicines Agency)
- JO (Journal officiel) Laboratoire Vertex Pharmaceuticals
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes 2 commentaires
2 commentaires 





Commentaires
Cliquez ici pour revenir à l'accueil.