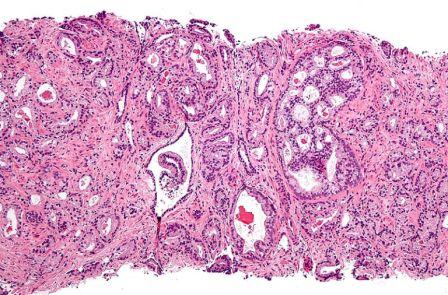
Coupe histologique d’un adénocarcinome de la prostate (© Néphron, Wikimedia)
JEVTANA 60 mg solution à diluer et solvant pour perfusion se compose de carbazitaxel une nouvelle substance active antinéoplasique de la famille des taxanes.
Il est indiqué, en association à la prednisone ou à la prednisolone, dans le traitement des patients avec un cancer de la prostate métastatique, hormonorésistant, précédemment traités par un traitement à base de docétaxel.
Il est indiqué, en association à la prednisone ou à la prednisolone, dans le traitement des patients avec un cancer de la prostate métastatique, hormonorésistant, précédemment traités par un traitement à base de docétaxel.
En pratique
L'utilisation de JEVTANA doit être réservée aux unités spécialisées dans l'administration de cytotoxiques.
L'administration doit être réalisée sous contrôle d'un médecin ayant l'expérience dans l'utilisation des chimiothérapies anticancéreuses. Les moyens et l'équipement pour le traitement de réactions sévères d'hypersensibilité comme l'hypotension et le bronchospasme doivent être disponibles.
La posologie recommandée de JEVTANA est de 25 mg/m² administrés par perfusion de 1 heure toutes les 3 semaines en association avec 10 mg par jour de prednisone ou de prednisolone administrée par voie orale pendant tout le traitement.
Une modification de la dose doit être faite chez les patients ayant présenté certains effets indésirables de type neutropénie ou diarrhée (Cf. monographie VIDAL).
La posologie recommandée de JEVTANA est de 25 mg/m² administrés par perfusion de 1 heure toutes les 3 semaines en association avec 10 mg par jour de prednisone ou de prednisolone administrée par voie orale pendant tout le traitement.
Une modification de la dose doit être faite chez les patients ayant présenté certains effets indésirables de type neutropénie ou diarrhée (Cf. monographie VIDAL).
Une prémédication doit être faite au moins 30 minutes avant chaque administration de JEVTANA avec les médicaments injectés par voie intraveineuse suivants afin de diminuer le risque et la sévérité de l'hypersensibilité :
- antihistaminique (dexchlorphéniramine 5 mg ou diphénhydramine 25 mg ou équivalent),
- corticostéroïde (dexaméthasone 8 mg ou équivalent),
- et antagoniste H2 (ranitidine ou équivalent).
Une prophylaxie antiémétique est recommandée et peut être donnée oralement ou par voie intraveineuse si besoin.
Au cours du traitement, une hydratation adéquate du patient doit être garantie, pour prévenir des complications comme une insuffisance rénale.
Modalités de préparation
JEVTANA comporte :
- un flacon de 1,5 ml de solution à diluer contenant 60 mg de cabazitaxel (40 mg/ml),
- et un flacon de solvant de 4,5 ml.
Après dilution initiale avec la totalité du solvant, chaque ml de la solution obtenue contient 10 mg de cabazitaxel.
La dilution initiale (première étape) de la solution à diluer doit être réalisée avec le solvant fourni.
La solution obtenue doit être immédiatement diluée (dans l'heure).
La préparation de la solution pour perfusion (deuxième étape) nécessite de prélever avec une seringue graduée le volume de solution obtenue à partir de la dilution initiale (à 10 mg/ml) correspondant à la dose de cabazitaxel prescrite.
Le volume extrait est injecté soit dans une solution de glucose 5 %, soit dans une solution de chlorure de sodium 0,9 %.
La solution pour perfusion doit être utilisée immédiatement. Toutefois, la durée de conservation peut être plus longue sous certaines conditions (Cf. monographie VIDAL).
La solution obtenue doit être immédiatement diluée (dans l'heure).
La préparation de la solution pour perfusion (deuxième étape) nécessite de prélever avec une seringue graduée le volume de solution obtenue à partir de la dilution initiale (à 10 mg/ml) correspondant à la dose de cabazitaxel prescrite.
Le volume extrait est injecté soit dans une solution de glucose 5 %, soit dans une solution de chlorure de sodium 0,9 %.
La solution pour perfusion doit être utilisée immédiatement. Toutefois, la durée de conservation peut être plus longue sous certaines conditions (Cf. monographie VIDAL).
Identité administrative
- Liste I
- Réservé à l'usage hospitalier
- Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Boîte unitaire de 1 flacon de solution à diluer + 1 flacon de solvant, CIP 3400957984977
- Agrément aux collectivités
- Inscrit sur la liste des spécialités prises en charge en sus des GHS
- Laboratoire Sanofi France
Informations communiquées par le laboratoire
Lettre du laboratoire aux urologues et aux oncologues (laboratoire Sanofi, septembre 2013)
Lettre du laboratoire aux pharmaciens hospitaliers (laboratoire Sanofi, septembre 2013)
Lettre du laboratoire aux pharmaciens hospitaliers (laboratoire Sanofi, septembre 2013)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire.png)
.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.