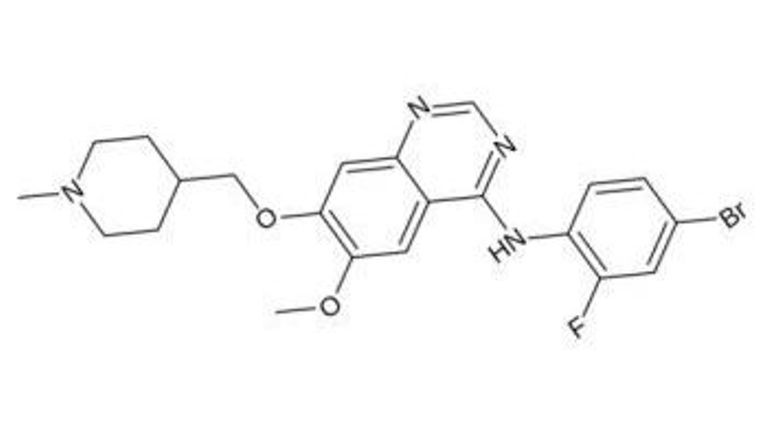
Le vandétanib est un nouveau principe actif antinéoplasique, de la classe thérapeutique des inhibiteurs de protéine kinase (image : © Fvasconcellos, Wikimedia).
CAPRELSA comprimé pelliculé est indiqué dans le traitement du cancer médullaire de la thyroïde (CMT) agressif et symptomatique chez les patients avec une maladie localement avancée non opérable ou métastatique.
Chez les patients pour lesquels la mutation réarrangée au cours d'une transfection (RET) n'est pas connue ou est négative, l'éventualité d'un bénéfice plus faible doit être prise en considération avant la décision d'un traitement individuel.
Dosages et délivrance
Deux dosages sont disponibles, à 100 mg et 300 mg, en ville et à l'hôpital.
CAPRELSA 100 mg était déjà commercialisé à l'hôpital depuis 2012, après avoir bénéficié d'une ATU (autorisation temporaire d'utilisation) pendant 2 ans (depuis août 2010).
Quelques mots sur le vandétanib
CAPRELSA appartient à la classe thérapeutique des agents antinéoplasiques, inhibiteurs de protéine kinase.
Il se compose d'un nouveau principe actif, le vandétanib, un inhibiteur puissant du récepteur 2 du facteur de croissance de l'endothélium vasculaire (VEGFR-2 est aussi connu comme un récepteur contenant le domaine d'insertion kinase [KDR]), et des tyrosines kinase du récepteur du facteur de croissance épidermique (EGFR) et récepteurs à tyrosine kinase RET. Le vandétanib est également un inhibiteur submicromolaire du récepteur 3 de la tyrosine kinase de l'endothélium vasculaire.
Il se compose d'un nouveau principe actif, le vandétanib, un inhibiteur puissant du récepteur 2 du facteur de croissance de l'endothélium vasculaire (VEGFR-2 est aussi connu comme un récepteur contenant le domaine d'insertion kinase [KDR]), et des tyrosines kinase du récepteur du facteur de croissance épidermique (EGFR) et récepteurs à tyrosine kinase RET. Le vandétanib est également un inhibiteur submicromolaire du récepteur 3 de la tyrosine kinase de l'endothélium vasculaire.
CAPRELSA en pratique
Le traitement par CAPRELSA doit être instauré et supervisé par un médecin expérimenté dans le traitement du CMT et dans l'utilisation des médicaments anticancéreux, et expérimenté dans l'évaluation des électrocardiogrammes (ECG).
Une seule délivrance par prescription est autorisée. Pour une délivrance supplémentaire, une nouvelle prescription est requise.
Les patients traités par CAPRELSA doivent avoir en leur possession la carte d'alerte pour le patient (cf. § Médicament sous surveillance renforcée) et être informés des risques de CAPRELSA.
La dose recommandée de vandétinib est de 300 mg à prendre 1 fois par jour, avec ou sans aliment, à peu près à la même heure chaque jour.Les patients traités par CAPRELSA doivent avoir en leur possession la carte d'alerte pour le patient (cf. § Médicament sous surveillance renforcée) et être informés des risques de CAPRELSA.
En cas d'oubli d'une dose, celle-ci doit être prise aussitôt que le patient s'en rend compte. Si le délai avant la prise de la dose suivante est inférieur à 12 heures, le patient ne doit pas prendre la dose omise. Les patients ne doivent pas prendre une dose double (deux doses en même temps) afin de compenser la dose oubliée.
Le vandétanib peut être administré jusqu'à ce que les patients atteints d'un CMT n'aient plus de bénéfice du traitement.
Pour les patients qui ont des difficultés à avaler, les comprimés de CAPRELSA peuvent être dispersés dans un demi-verre d'eau non gazeuse. Aucun autre liquide ne doit être utilisé. Le comprimé doit être mis sans l'écraser dans l'eau, remué jusqu'à ce qu'il soit dispersé (environ 10 minutes) et la dispersion obtenue doit être bue immédiatement. Tout résidu dans le verre doit être mélangé avec un demi-verre d'eau et bu.
Le liquide peut également être administré par une sonde nasogastrique ou de gastrostomie.
Le liquide peut également être administré par une sonde nasogastrique ou de gastrostomie.
L'intervalle QTc, un élément à prendre en compte
Le vandétanib à la dose de 300 mg est associé à un allongement substantiel du QTc dépendant de la concentration.
CAPRELSA ne doit pas être utilisé chez les personnes qui présentent un syndrome du QTc long congénital ou un intervalle QTc supérieur à 480 millisecondes, ainsi que chez les patients qui prennent certains autres médicaments pouvant allonger l'intervalle QTc.
Avant l'initiation du traitement par CAPRELSA, l'intervalle QTc doit être soigneusement évalué. En cas de toxicité de grade 3 évaluée selon les critères de terminologie standards pour les évènements indésirables (CTCAE : Common Terminology Criteria for Adverse Events) ou d'une toxicité supérieure ou d'un allongement de l'intervalle QTc à l'ECG (électrocardiogramme), l'administration du vandétanib doit être au moins temporairement arrêtée, et reprise à une dose réduite quand la toxicité a disparu ou s'est améliorée au grade CTCAE 1. La dose quotidienne de 300 mg peut être réduite à 200 mg (2 comprimés de 100 mg), puis à 100 mg si nécessaire.
Le patient doit être surveillé de manière appropriée.
Étant donné la demi-vie de 19 jours, les effets indésirables dont l'allongement de l'intervalle QTc peuvent ne pas se résoudre rapidement.
Médicament sous surveillance renforcée
CAPRELSA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : ANSM (Agence nationale de sécurité du médicament et des produits de santé) et réseau des Centres Régionaux de Pharmacovigilance (site internet : www.ansm.sante.fr).
Un PGR (plan de gestion de risques) accompagne la commercialisation de ce médicament. Il est destiné à sensibiliser les prescripteurs sur les risques d'allongement du QTc, de torsades de pointes, de mort subite et de syndrome d'encéphalopathie postérieure réversible (SERP) associés à la prise de CAPRELSA.
Dans le cadre de ce PGR, l'ensemble des prescripteurs potentiels a reçu du laboratoire un dossier éducationnel contenant les éléments suivants :
- le résumé des caractéristiques du produit (RCP) et la notice ;
- le matériel éducationnel pour les professionnels de santé contenant les éléments clés relatifs à la sécurité d'emploi de CAPRELSA et aux risques liés à ce traitement ;
- des Cartes d'Alerte pour les Patients, à remettre par le prescripteur aux patients afin de les informer sur les risques liés à CAPRELSA.
Identité administrative
- Liste I
- Prescription hospitalière, réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Remboursable à 100 %
- CAPRELSA 100 mg, boîte de 30, CIP 3400922066806, prix public TTC = 1 556,29 euros
- CAPRELSA 300 mg, boîte de 30, CIP 3400922066974, prix public TTC = 4 586,61 euros
- Agrément aux collectivités
- Laboratoire AstraZeneca
Sources et ressources complémentaires
CAPRELSA : résumé à l'intention du public (EMA, 2012)
Plan de gestion de risques de CAPRELSA (EMA, 2 mars 2012)
Synthèse d'avis de la Commission de la transparence (HAS, juin 2012)
Plan de gestion de risques de CAPRELSA (EMA, 2 mars 2012)
Synthèse d'avis de la Commission de la transparence (HAS, juin 2012)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.