| Poudre (en flacon) : | par flacon |
Octréotide acétate exprimé en octréotide
| 10 mg |
| ou | 20 mg |
| ou | 30 mg |
Excipients : Poudre (en flacon) : poly (DL-lactide-co-glycolide), mannitol (E421).
Solvant (en seringue préremplie) : carmellose sodique, mannitol (E421), poloxamer 188, eau pour préparations injectables.
- Traitement de l'acromégalie chez les patients pour lesquels la chirurgie est inadaptée ou inefficace, ou pendant la période transitoire précédant la complète efficacité de la radiothérapie (cf Posologie et Mode d'administration).
- Traitement des patients avec des symptômes associés aux tumeurs endocrines gastro-entéro-pancréatiques fonctionnelles, par exemple les tumeurs carcinoïdes avec signe(s) clinique(s) d'un syndrome carcinoïde (cf Pharmacodynamie).
- Traitement des patients atteints de tumeurs neuroendocrines avancées de l'intestin moyen ou de localisation primitive inconnue lorsque les sites primitifs ne correspondant pas à l'intestin moyen ont été exclus.
- Traitement des adénomes thyréotropes :
- lorsque la sécrétion n'est pas normalisée après chirurgie et/ou radiothérapie ;
- chez les patients ne relevant pas d'un traitement chirurgical ;
- chez les patients irradiés, en attente de l'efficacité de la radiothérapie.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
-
Générales :
- Les adénomes hypophysaires somatotropes peuvent parfois augmenter de volume, entraînant des complications sévères (par exemple une altération du champ visuel), il est donc important de surveiller attentivement tous les patients. En cas d'augmentation de volume de l'adénome, des alternatives thérapeutiques devraient être envisagées.
- Les bénéfices thérapeutiques d'une diminution du taux de l'hormone de croissance (GH) et de la normalisation des taux d'IGF-1 chez les patientes acromégales sont susceptibles de restaurer la fertilité. Il est donc conseillé aux femmes en âge de procréer d'utiliser un moyen de contraception adéquat si nécessaire durant un traitement par octréotide (cf Fertilité/Grossesse/Allaitement).
- Un suivi de la fonction thyroïdienne doit être réalisé chez les patients traités au long cours par octréotide.
- Un suivi de la fonction hépatique doit être réalisé au cours du traitement par octréotide.
-
Effets cardiovasculaires :
- Des cas fréquents de bradycardie ont été rapportés. Une adaptation posologique de médicaments tels que les bêtabloquants, les inhibiteurs calciques ou les substances agissant sur l'équilibre hydroélectrolytique peut être nécessaire (cf Interactions).
-
Vésicule biliaire et réactions associées :
- La cholélithiase est un événement très fréquent au cours du traitement par Sandostatine et peut être associée à une cholécystite et à une dilatation des voies biliaires (cf Effets indésirables).
- De plus, après commercialisation, des cas de cholangites ont été rapportés comme une complication de la cholélithiase chez les patients prenant Sandostatine LP.
- Il est recommandé d'effectuer une échographie de la vésicule biliaire avant l'initiation du traitement par Sandostatine LP puis tous les 6 mois environ pendant le traitement.
-
Métabolisme du glucose :
- Sandostatine LP peut altérer la glycorégulation en raison de son action inhibitrice sur les sécrétions de GH, glucagon et insuline. La tolérance au glucose postprandial peut être perturbée. Comme cela a été rapporté avec Sandostatine SC, dans certains cas, une hyperglycémie persistante peut résulter d'une administration chronique. Des cas d'hypoglycémie ont également été rapportés.
- Sandostatine LP peut interférer avec le métabolisme du glucose et réduire les besoins en insuline chez le diabétique de type 1. Chez les patients non diabétiques et les patients présentant un diabète de type 2 avec des réserves en insuline partiellement intactes, l'administration de Sandostatine SC pourrait augmenter la glycémie postprandiale. Ainsi, il est recommandé de suivre régulièrement la glycémie et le traitement antidiabétique.
- Chez les patients ayant un insulinome, l'octréotide peut augmenter l'intensité et la durée de l'hypoglycémie. Ceci s'explique par le fait que l'octréotide inhibe de manière relativement plus importante la sécrétion de GH et du glucagon que celle de l'insuline, et que la durée de son action inhibitrice est plus courte sur l'insuline. Ces patients doivent être étroitement surveillés.
-
Nutrition :
- Chez certains patients, l'octréotide peut diminuer l'absorption des lipides alimentaires.
- Chez certains patients traités avec l'octréotide, une diminution du taux de vitamine B12 et un test de Schilling anormal ont été observés. Il est recommandé de contrôler le taux de vitamine B12 pendant le traitement par Sandostatine LP chez les patients ayant des antécédents de carence en vitamine B12.
-
Fonction pancréatique :
- Une insuffisance pancréatique exocrine (IPE) a été observée chez certains patients recevant un traitement par l'octréotide pour des tumeurs neuroendocrines gastroentéropancréatiques. Les symptômes de l'IPE peuvent inclure une stéatorrhée, des selles molles, des ballonnements abdominaux et une perte de poids. Un dépistage et un traitement approprié de l'IPE conformément aux directives cliniques doivent être envisagés chez les patients symptomatiques.
-
Teneur en sodium :
- Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon, c'est-à-dire qu'il est essentiellement « sans sodium ».
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse :
Les données sur l'exposition de la femme enceinte à l'octréotide sont limitées (moins de 300 grossesses), et dans environ un tiers de ces cas, les données sur l'issue des grossesses ne sont pas connues. La majorité des rapports a été reçue après la commercialisation de l'octréotide et plus de la moitié des expositions à l'octréotide pendant la grossesse a été rapportée chez des patientes acromégales. La plupart des patientes avaient été exposées à l'octréotide pendant le premier trimestre de la grossesse, à des doses comprises entre 100 et 1200 microgrammes/jour de Sandostatine SC, ou entre 10 et 40 mg/mois de Sandostatine LP. Des anomalies congénitales ont été rapportées dans environ 4 % des cas de grossesse dont l'issue est connue, sans qu'aucun lien de causalité n'ait été établi avec la prise d'octréotide.
Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction (cf Sécurité préclinique).
Par précaution, il est préférable de ne pas utiliser Sandostatine LP au cours de la grossesse (cf Mises en garde et Précautions d'emploi).
Allaitement :
On ne sait pas si l'octréotide est excrété dans le lait maternel. Des études chez l'animal ont montré que l'octréotide est excrété dans le lait maternel. Au cours du traitement par Sandostatine LP, les patientes ne doivent pas allaiter.
Fertilité :
On ne sait pas si l'octréotide a un effet sur la fertilité humaine. Une descente tardive des testicules a été observée chez les descendants mâles des femelles traitées durant la grossesse et l'allaitement. Cependant, l'octréotide n'a pas altéré la fertilité des rats mâles et femelles traités à des doses allant jusqu'à 1 mg/kg de poids corporel par jour (cf Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
Sandostatine LP n'a aucun effet ou qu'un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines. Les patients devront être incités à la prudence s'ils conduisent des véhicules ou utilisent des machines s'ils ressentent des sensations vertigineuses, de l'asthénie/de la fatigue ou des céphalées au cours d'un traitement par Sandostatine LP.
Un nombre limité de surdosages accidentels avec Sandostatine LP a été rapporté. La dose allait de 100 mg à 163 mg/mois de Sandostatine LP. Le seul effet indésirable rapporté a été des bouffées de chaleur.
Des cas de patients atteints de cancer recevant des doses de Sandostatine LP allant jusqu'à 60 mg/mois et jusqu'à 90 mg toutes les 2 semaines ont été rapportés. Ces doses ont été en général bien tolérées. Cependant les effets indésirables suivants ont été rapportés : mictions fréquentes, fatigue, dépression, anxiété et altération de la concentration.
La prise en charge du surdosage est symptomatique.
Les études de toxicité aiguë et répétée, de génotoxicité, de cancérogenèse et de toxicité sur la reproduction chez l'animal n'ont pas révélé de risque particulier pour l'homme.
Les études sur la reproduction menées chez l'animal n'ont mis en évidence aucun effet tératogène, embryo/fœtotoxique ou délétère sur la reproduction après administration de l'octréotide aux parents à des doses allant jusqu'à 1 mg/kg/jour. Un léger ralentissement de la croissance physiologique a été noté dans la descendance du rat, mais ce ralentissement était transitoire et imputable à l'inhibition de la GH due à une activité pharmacodynamique excessive (cf Fertilité/Grossesse/Allaitement).
Aucune étude spécifique n'a été menée chez le rat jeune. Lors des études de développement pré- et postnatal, un retard de croissance et de maturation a été observé chez les sujets de la génération F1 des mères ayant reçu l'octréotide pendant toute la durée de la grossesse et la période de lactation. Une descente tardive des testicules a été observée chez les descendants mâles de la génération F1, mais aucun effet délétère n'a été observé sur la fertilité des mâles de la génération F1 touchés. Ainsi, les effets mentionnés ci-dessus étaient temporaires et considérés comme consécutifs à l'inhibition de la GH.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
MODALITÉS DE CONSERVATION |
Durée de conservation avant reconstitution : 3 ans.
A conserver dans l'emballage d'origine, à l'abri de la lumière.
A conserver au réfrigérateur (2 °C à 8 °C). Ne pas congeler.
Sandostatine LP peut être conservé à une température ne dépassant pas 25 °C le jour de l'injection.
Le produit ne doit pas être conservé après reconstitution (il doit être utilisé immédiatement).
MODALITÉS MANIPULATION/ÉLIMINATION |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
-
Instructions relatives à la préparation et à l'administration intramusculaire de Sandostatine LP :
-
Pour injection intramusculaire profonde seulement.
- Le kit d'injection comprend :
-
- Un flacon contenant la poudre de Sandostatine LP.
- Une seringue préremplie contenant le solvant de reconstitution.
- Un adaptateur pour flacon pour la reconstitution du produit.
- Une aiguille d'injection sécurisée.
- Les instructions ci-dessous doivent être suivies avec attention afin de garantir la bonne reconstitution de Sandostatine LP avant son administration intramusculaire profonde.
- Il y a 3 étapes critiques lors de la reconstitution de la suspension de Sandostatine LP. Ne pas les respecter peut empêcher la bonne administration du produit.
-
-
Le kit d'injection doit être à température ambiante. Sortir le kit d'injection du réfrigérateur et le laisser à température ambiante pendant au moins 30 minutes avant la reconstitution, mais sans dépasser 24 heures.
- Après avoir ajouté le solvant dans le flacon, laisser reposer ce dernier pendant 5 minutes pour laisser la poudre s'humidifier totalement.
- Après humidification, secouer modérément le flacon à l'horizontale pendant 30 secondes minimum jusqu'à la formation d'une suspension homogène. La suspension de Sandostatine LP doit être préparée immédiatement avant l'administration.
- Sandostatine LP doit être administrée exclusivement par un personnel de santé entraîné.
-
Étape 1 :
-
- Sortir le kit d'injection Sandostatine LP du réfrigérateur.
-
Attention : il est essentiel de commencer la reconstitution une fois que le kit d'injection est revenu à température ambiante. Pour cela, laisser le kit à température ambiante pendant un minimum de 30 minutes avant la reconstitution, mais sans dépasser 24 heures.
-
- Remarque : le kit d'injection peut être remis au réfrigérateur si nécessaire.
-
Étape 2 :
-
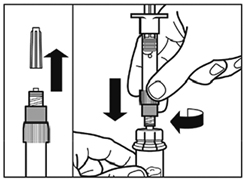
- Retirer l'opercule de plastique du flacon et désinfecter le bouchon de caoutchouc du flacon avec un tampon alcoolisé.
- Retirez le film couvrant l'adaptateur du flacon, mais ne pas sortir l'adaptateur de son conditionnement.
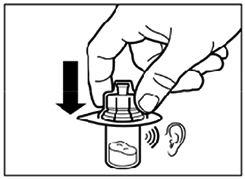
- En le tenant par son conditionnement, poser l'adaptateur sur le dessus du flacon et le pousser vers le bas de telle sorte qu'il se fixe en laissant entendre un « clic ».
- Retirer le conditionnement de l'adaptateur par un mouvement vertical.
-
Étape 3 :
-
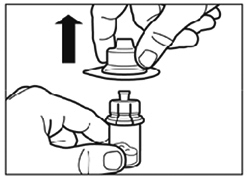
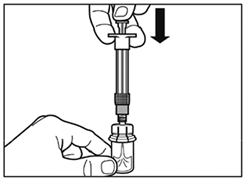
- Retirer le capuchon de la seringue préremplie de solvant et visser la seringue sur l'adaptateur du flacon.
- Poussez lentement le piston jusqu'en bas pour transférer tout le solvant dans le flacon.
-
Étape 4 :
-
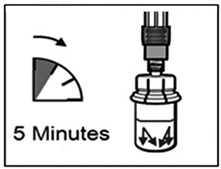
Attention : il est essentiel de laisser le flacon reposer pendant 5 minutes afin de s'assurer que le solvant a complètement humidifié la poudre.
-
- Remarque : il est normal que le piston remonte car il peut y avoir une légère surpression dans le flacon.
-
- A ce stade, préparer le patient pour l'injection.
-
Étape 5 :
-
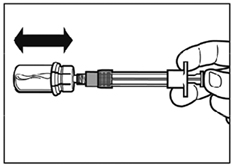
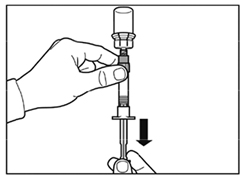
- Après la période d'humidification, s'assurer de bien repousser le piston jusqu'en bas de la seringue.
-
Attention : Maintenir le piston appuyé et secouer le flacon modérément à l'horizontale pendant minimum 30 secondes de telle sorte que la poudre soit complètement mise en suspension (suspension laiteuse homogène). Secouer de nouveau modérément pendant 30 secondes si la poudre n'est pas complètement mise en suspension.
-
Étape 6 :
-
- Préparer le site d'injection avec un tampon alcoolisé.
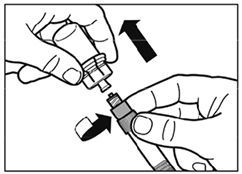
- Retourner la seringue et le flacon tête en bas, tirer doucement le piston et aspirer entièrement le contenu du flacon dans la seringue.
- Dévisser la seringue de l'adaptateur.
-
Étape 7 :
-
- Vissez l'aiguille d'injection sécurisée sur la seringue.
- Agiter de nouveau la seringue doucement pour s'assurer d'une suspension laiteuse homogène.
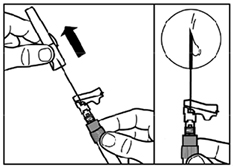
- Retirer le capuchon protecteur de l'aiguille d'injection.
- Tapoter doucement la seringue pour éliminer les bulles visibles et les chasser hors de la seringue. Vérifier que le site d'injection n'a pas été contaminé.
- Procéder immédiatement à l'étape 8 pour l'administration au patient. Tout retard peut entraîner une sédimentation.
-
Étape 8 :
-
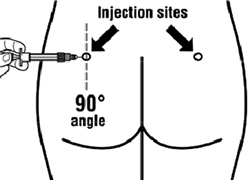
- Sandostatine LP doit être injecté exclusivement par voie intramusculaire profonde ; jamais par voie intraveineuse.
- Piquer l'aiguille profondément dans le muscle fessier gauche ou droit avec un angle de 90 ° par rapport à la peau.
- Tirer lentement le piston pour vérifier qu'aucun vaisseau n'a été touché (repiquer si un vaisseau a été touché).
- Pousser lentement le piston jusqu'à ce que la seringue soit vide. Retirer l'aiguille du point d'injection et utiliser le dispositif de sécurité (comme expliqué à l'étape 9).
-
Étape 9 :
-
- Placer le dispositif de sécurité sur l'aiguille selon l'une des 2 méthodes suivantes :
- soit presser la charnière du volet de sécurité à plat sur une surface rigide (figure A),
- soit pousser la charnière en avant avec le doigt (figure B).
- Un « clic » sonore confirme la mise en place correcte.
- Jeter immédiatement la seringue (dans un container adapté).
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
LISTE I
| Prescription initiale hospitalière annuelle. |
| AMM | 3400930021477 (2004, RCP rév 21.11.2025) 10 mg. |
| 3400930021484 (2004, RCP rév 21.11.2025) 20 mg. |
| 3400930021545 (2004, RCP rév 21.11.2025) 30 mg. |
| | |
| Prix : | 393,21 euros (poudre et solvant à 10 mg). |
| 461,78 euros (poudre et solvant à 20 mg). |
| 532,04 euros (poudre et solvant à 30 mg). |
| Remb Séc soc à 100 %. Collect. |
|
Sandostatine LP 30 mg est de plus remb Séc soc à 100 % et Collect dans le « Traitement des patients atteints de tumeurs neuroendocrines avancées, non progressives et avec un index KI 67 ≤ 10 %, ayant pour origine l'intestin moyen ou de localisation primitive inconnue lorsque les sites primitifs ne correspondant pas à l'intestin moyen ont été exclus ».
|