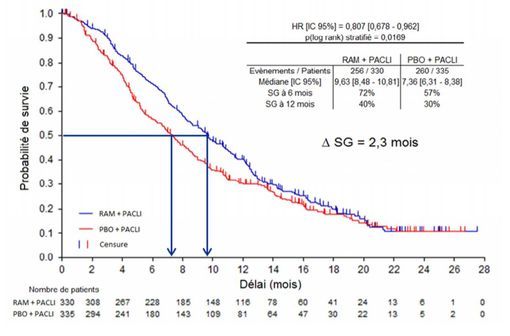
Etude RAINBOW – Médiane de survie globale - Courbe de Kaplan-Meier de SG (population ITT).
Agrément aux collectivités en association avec le paclitaxel
Dans le Journal officiel du 7 juillet 2016, CYRAMZA 10 mg/mL solution à diluer pour perfusion (ramucirumab) est inscrit sur la liste des spécialités agréées aux collectivités.
Suivant l'avis de la Commission de la transparence du 17 juin 2015, le périmètre de prise en charge de CYRAMZA concerne son utilisation en association au paclitaxel, dans le traitement des patients adultes atteints d'un cancer gastrique ou d'un adénocarcinome de la jonction gastro-œsophagienne avancés dont la maladie a progressé après une chimiothérapie à base de sels de platine et de fluropyrimidine, associée au trastuzumab en cas de surexpression HER2.
Dans cette indication, la Commission de la transparence a attribué un SMR (service médical rendu) modéré à CYRAMZA sur la base des résultats de l'étude RAINBOW (phase III), ayant comparé le ramucirumab en association au paclitaxel versus le paclitaxel seul (avec placebo).
Au cours de cette étude, 665 patients présentant un cancer gastrique ou un adénocarcinome de la jonction gastro-œsophagienne métastatique ou localement avancé ont été randomisés, en double aveugle.
Le ramucirumab était utilisé en seconde ligne, après échec d'une chimiothérapie à base d'un sel de platine et/ou d'une fluoropyrimidine, à la posologie de 8 mg/kg à J1 et J15, sur un cycle de 28 jours.
En termes d'efficacité, le critère de jugement principal était la survie globale.
Les résultats de cette étude montrent :
- un gain absolu de 2,3 mois de la médiane de survie globale (9,6 mois versus 7,4 mois ; HR = 0,81 ; IC 95% [0,68-0,96] ; p=0,017),
- un gain de 1,5 mois de la médiane de survie sans progression,
- une absence d'amélioration de la qualité de vie,
- une augmentation des arrêts de traitement pour événements indésirables.
Pour la Commission de la transparence, ces résultats sont en faveur d'un impact faible en termes de morbi-mortalité et de qualité de vie.
En monothérapie : un intérêt clinique insuffisant
Dans le traitement des patients adultes atteints d'un cancer gastrique ou d'un adénocarcinome de la jonction gastro-oesophagienne avancés dont la maladie a progressé après une chimiothérapie à base de sels de platine ou de fluoropyrimidine et pour lesquels un traitement en association avec le paclitaxel n'est pas approprié, l'utilisation de CYRAMZA en monothérapie n'a pas été retenue pour être prise en charge par l'Assurance maladie.
La Commission de la transparence s'est appuyée sur les résultats de l'étude REGARD, ayant comparé le ramucirumab (8 mg/kg) au placebo, selon lesquels :
- le gain absolu en termes de survie globale (critère principal de jugement) a été de 1,4 mois (5,2 mois versus 3,8 mois),
- le gain absolu en termes de survie sans progression a été de 0,8 mois (2,1 mois versus 1,3 mois ; HR = 0,48 ; IC 95% [0,38-0,62] ; p<0,0001),
- la qualité de vie n'a pas été améliorée,
- les arrêts de traitement pour effets indésirables ont augmenté.
Pour la Commission de la transparence, ces résultats n'ont pas permis de démontrer l'intérêt clinique de CYRAMZA en monothérapie.
En outre, il est rappelé que la France, avec 7 autres états membres, s'étaient positionnés défavorablement pour attribuer une AMM à CYRAMZA en monothérapie, contre l'avis du CHMP.
Pour mémoire : CYRAMZA en France
CYRAMZA a fait l'objet d'une ATU (autorisation temporaire d'utilisation) nominative puis d'une ATU de cohorte jusqu'en décembre 2014, dans le traitement de deuxième ligne adénocarcinome gastrique ou de la jonction gastro-œsophagienne, uniquement en association avec le paclitaxel.
Il a été commercialisé en France en juin 2015 (notre article du 2 juin 2015), uniquement à l'hôpital.
CYRAMZA a reçu une AMM (autorisation de mise sur le marché) dans 4 indications :
- cancer gastrique ou adénocarcinome de la jonction gastro-œsophagienne :
- en association avec le paclitaxel, pour le traitement des patients adultes atteints d'un cancer gastrique ou d'un adénocarcinome de la jonction gastro-œsophagienne avancés dont la maladie a progressé après une chimiothérapie à base de sels de platine et de fluoropyrimidine ;
- en monothérapie, pour le traitement des patients adultes atteints d'un cancer gastrique ou d'un adénocarcinome de la jonction gastro-œsophagienne avancés dont la maladie a progressé après une chimiothérapie à base de sels de platine ou de fluoropyrimidine et pour lesquels un traitement en association avec le paclitaxel n'est pas approprié ;
- cancer colorectal métastatique : en association avec la chimiothérapie FOLFIRI (irinotécan, acide folinique et 5-fluorouracile), dans le traitement des patients adultes atteints d'un cancer colorectal métastatique (CCRM) dont la maladie a progressé pendant ou après un traitement par bevacizumab, oxaliplatine et une fluoropyrimidine ;
- cancer bronchique non à petites cellules : en association avec le docétaxel, dans le traitement des patients adultes atteints d'un cancer bronchique non à petites cellules localement avancé ou métastatique dont la maladie a progressé après une chimiothérapie à base de sels de platine.
CYRAMZA n'a pas encore été évalué par la Commission de la transparence dans le cancer colorectal métastatique et dans le cancer bronchique non à petites cellules,.
Pour aller plus loin
Arrêté du 14 juin 2016 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 7 juillet 2016 - texte 14)
Avis de la Commission de la Transparence relatif à la prise en charge de CYRAMZA (HAS, 17 juin 2015)
Sur Vidal.fr
CYRAMZA (ramucirumab) : nouveau principe actif dans la prise en charge du cancer gastrique avancé (2 juin 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)
.jpg)





Commentaires
Cliquez ici pour revenir à l'accueil.