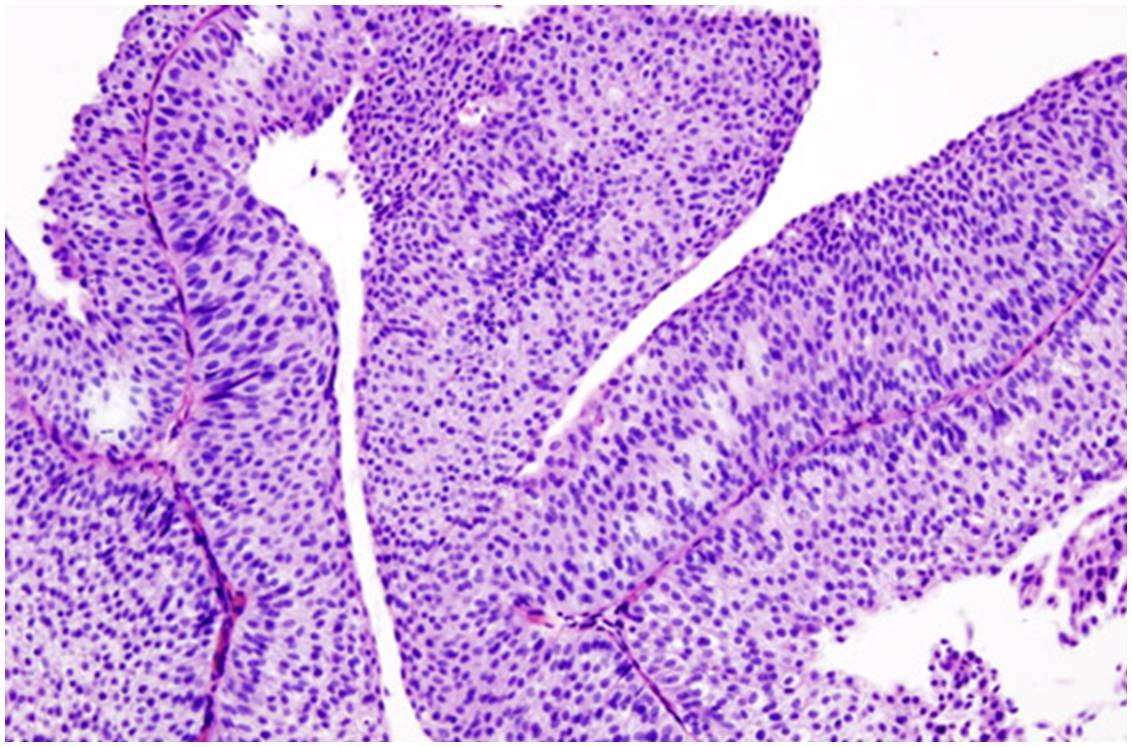
Image histopathologique d'un carcinome urothélial de la vessie de stade pT1. Biopsie transurétrale (cliché @ Wikimedia).
Depuis octobre 2012, afin de pallier la rupture de stock d'IMMUCYST 81 mg poudre pour suspension intra-vésicale indisponible pour raison industrielle, les spécialités BCG-MEDAC et ONCOTICE sont utilisées pour l'immunothérapie par BCG en instillation intravésicale.
La spécialité ONCOTICE poudre pour suspension intravésicale est une spécialité importée, initialement destinée au marché canadien, mise à disposition en France par le laboratoire MSD France.
Les spécialités BCG-MEDAC et ONCOTICE rencontrent elles aussi des difficultés d'approvisionnement, conduisant à la mise en place de mesures temporaires afin d'assurer la continuité des soins chez les patients atteints de cancer de la vessie.
Disponibilité d'ONCOTICE et de BCG-MEDAC
A ce jour, la spécialité BCG-MEDAC est en rupture de stock. Une remise à disposition est prévue en octobre 2014.
Concernant la spécialité ONCOTICE, un risque de rupture de stock est prévu à compter de début octobre 2014 pour une durée minimale de 3 semaines (remise à disposition fin octobre).
Du fait de la disponibilité d'un stock très limité, le laboratoire MSD a décidé de mettre en place un contingentement strict de cette spécialité.
Les unités restantes doivent être réservées de façon prioritaire aux patients ayant une tumeur de la vessie non infiltrant le muscle (TVNIM) à risque élevé de récidive et de progression.
Il est par ailleurs recommandé :
- de limiter le traitement d'induction à 6 instillations (une instillation intravésicale par semaine pendant 6 semaines).
- de ne pas réaliser de traitement d'entretien.
Recommandations temporaires pour assurer la continuité des soins
En attendant la remise à disposition de BCG intravésical en quantités suffisantes, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) et l'AFU (Association française d'urologie) ont formulé des recommandations temporaires à destination des urologues et des oncologues.
Ces recommandations sont adaptées à la situation actuelle, correspondant à une disponibilité en quantités limitées de BCG. Dans ces conditions, deux situations sont envisagées :
- TVNIM de risque intermédiaire : les instillations endo-vésicales de mitomycine C demeurent le traitement de référence, avec l'utilisation éventuelle en seconde intention d'épirubicine ou éventuellement de doxorubicine. Le BCG ne doit pas être utilisé ;
- TVNIM de risque élevé : bien vérifier l'absence de résidu tumoral et de progression en pratiquant une seconde RTUV (résection endoscopique trans-urétrale complète de la tumeur de la vessie). S'il n'est pas retrouvé de tissu tumoral, le traitement d'induction doit être limité à 6 instillations. Si du tissu tumoral est retrouvé, une cystectomie totale d'emblée doit être proposée. En cas de traitement conservateur, un contrôle endoscopique devra être réalisé à 3 mois de la dernière résection, de préférence sous anesthésie (pour toute lésion dont le score pronostic est supérieur ou égal à 7) avec biopsie systématique de toute lésion d'allure suspecte.
Des recommandations complémentaires sont également émises afin de répondre à une situation potentielle de rupture de stock complète.
Selon ces recommandations, les TVNIM de risque élevé répondent aux critères de sélection d'une seconde RTUV, à réaliser 4 à 6 semaines après la première.
En l'absence de BCG, les experts considèrent qu'un traitement par instillations endo-vésicales de mitomycine C ou épirubicine (ou doxorubicine) demeure plus efficace que l'absence de tout traitement complémentaire, après s'être assuré par une cystoscopie de l'absence de tumeur résiduelle après la seconde RTUV.
L'ensemble de ces recommandations est détaillé dans le point d'information publié sur le site de l'ANSM.
Pour mémoire
IMMUCYST est indiqué dans le traitement des carcinomes urothéliaux non invasifs de la vessie :
- traitement prophylactique et curatif du carcinome urothélial in situ ;
- traitement prophylactique des rechutes de carcinome urothélial limité à la muqueuse :
- pTa G1-G2 si tumeur multifocale et/ou récidivante,
- pTa G3,
- carcinome urothélial envahissant la lamina propria mais non la musculeuse de la vessie (pT1).
Sources et ressources complémentaires
IMMUCYST 81 mg, poudre pour suspension intravésicale - Rupture de stock (ANSM, 8 septembre 2014)
Lettre du laboratoire MSD aux pharmaciens hospitaliers et médecins prescripteurs - rupture d'ONCOTICE (sur le site de l'ANSM, 5 septembre 2014)
BCG MEDAC, poudre et solvant pour suspension pour administration intravésicale (ANSM, 8 septembre 2014)
Spécialités pour instillations intra-vésicales à base de BCG (Immucyst®, BCG- Medac® et OncoTICE® ) : tensions d'approvisionnement et recommandations temporaires pour assurer la continuité des soins - Point d'information (ANSM, 8 septembre 2014)
Sur www.vidal.fr
IMMUCYST 81 mg poudre pour suspension intravésicale : remise à disposition reportée à 2015 (4 juillet 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.